肝门部胆管癌(hilar cholangiocarcinoma,HCCA)是源于胆管近端(主要位于左右肝管、肝总管)的恶性肿瘤,占胆道恶性肿瘤的6 0%~7 0%。该病发病隐匿,预后较差,目前无有效保守治疗方法。根治性手术切除是为患者提供了长期生存的唯一合适的治疗方法。自1965年Klatskin[1]首次对肝门周围胆管癌的研究以来,对其进行了多种类型的切除,从单纯肝外胆管切除到伴胰十二指肠切除和不伴胰十二指肠切除的肝叶切除[2-3],肝叶联合切除门静脉联合治疗局部晚期HCCA于1965年在东京肿瘤研究所医院首次成功实施[4]。经过半个世纪的发展,肝门周围胆管癌目前仍然是R0切除最困难的恶性肿瘤之一。由于肝门部特殊的解剖学位置及胆管癌的多极化浸润性生长的生物学特性,HCCA容易纵向扩展,导致侵犯肝门部血管[5]。血管侵犯一直是HCCA手术治疗的主要障碍,传统意义上肿瘤侵犯血管结构意味着不可切除的疾病。然而,随着微血管吻合技术和围手术期管理的改进,有观点[6]显示选择能够符合该术式适应证的患者进行血管切除和重建,可以达到R0切除状态和同等的长期生存率。近年来,一部分学者[7-8]表示对于联合血管切除及重建会增加手术并发症和术后病死率,也有学者[9-11]认为联合血管切除及重建在长期生存率方面具有积极意义,但其术式的安全性、有效性及远期疗效仍存在一定争议[7,11],本研究就HCCA联合血管切除及重建的安全性及近远期疗效进行了回顾并分析探讨,以期临床研究工作有所借鉴。
1 资料与方法
1.1 文献检索
为了评估联合血管与否之间关系的研究, 使用的英文检索词包括: Hilar Cholangiocarcinoma、Hilar Bile Duct Cancer、Klatskin Tumor、Vascular Resection、Hepatic Artery Resection、Portal Vein Resection;中文检索词包括:肝门部胆管癌、肝门胆管癌、Klatskin瘤、血管切除、肝动脉切除、门静脉切除。检索Cochrane Library、PubMed、Embase、CBM、中国知网、万方数据库、维普数据库。检索规定期限为2009年1月1日—2019年1月1日。并结合文献追溯的方法,手工检索了其他相关出版物检索到的相关文章的参考文献。文献检索不受语言 限制。
1.2 纳入标准和排除标准
1.2.1 纳入标准 (1) 研究类型:在2009年1月1日—2019年1月1日发表并提供基础数据的关于HCCA 根治术联合血管切除重建的相关中英文文献。(2) 研究对象:经术后病理学检查为HCCA的患者。(3)干预措施:对接受过HCCA 根治术的HCCA 患者,根据手术治疗中联合受累血管切除(血管切除组)与未切除血管(对照组)进行比较,前者包括肝动脉切除及重建和门静脉切除及重建;又将HCCA 患者分为R0 切除组与R1 切除组。 (4) 文献必须记录相关1 项或多项术后评价指标手术的安全性(并发症发生率、病死率)、有效切除性(R0 切除率)及近远期疗效(第1、3、5年总体生存率、R0 与R1 的5年生存率。(5) 若发现重复文献,仅纳入其中1 项。
1.2.2 排除标准 (1) 行姑息性手术或没有对照的联合血管切除重建根治书的文献;(2) 分组不明确、观察指标不符合纳入标准的文献;(3)原始数据不完整的文献;(4) 个案报告、病例数<10例;(5) 重复发表或数据重叠的文献。
1.3 文献筛选、数据提取及文献质量评价
由2名评价者独立检索并查看每1篇文献,若存在争议,通过与所有作者的讨论解决了分歧。从符合的研究提取以下数据:第一作者、发表日期、所在的国家地区、研究类型、病例数量、分组类型及各项结果等。采用纽卡斯堡-渥太华量表(NOS)对入选文献的质量进行了评定。此量表为星级评定。此表以分数代表☆,满分为9颗☆,5~9颗☆为相对高质量的文章。本文所纳入文献均≥5分。
1.4 统计学处理
应用RevMan 5.3.5软件进行统计学分析。计数资料采用比值比(odds ratio,OR)及其95%可信区间(confidence interval,CI)对合并效应量进行统计分析,若无法直接从原文获取生存率的相关指标,则采用Engauge Digitizer version 2.5软件从生存曲线上提取对应生存率,再进行合并分析。通过I2值,对异质性进行分析,若异质性检验P>0.05,I2<50%表明各研究间无明显异质性,分析采用固定效应模型。若I2>5 0%,P <0.0 5 存在异质性,则要采用随机效应模型分析并进行敏感性分析或亚组分析。除了进行总体分析之外,本研究还进行了部分分层亚组分析:门静脉切除亚组和对照组之间以及肝动脉切除亚组和对照组之间的比较,以探索不同血管切除重建的干预措施对于术后各项指标的影响。以漏斗图判断发表 偏倚。
2 结 果
2.1 文献检索结果
初步检索到相关文献2 312篇,其中中文文献1 798篇,外文数据库检索514篇。通过去除重复文献、阅读标题及摘要排除与研究无关的文献、按照纳入及排除标准,最终入选18篇文献[5,8,12-27], 均为回顾性研究,其中英文文献17篇,中文文献 1篇。检索流程详见图1。累计样本量为3 260例,其中血管切除组904例(肝动脉切除亚组:237例,门静脉切除亚组:560例,2项研究未分亚组),对照组2 356例。各项研究基本特征及文献质量评分见表1。
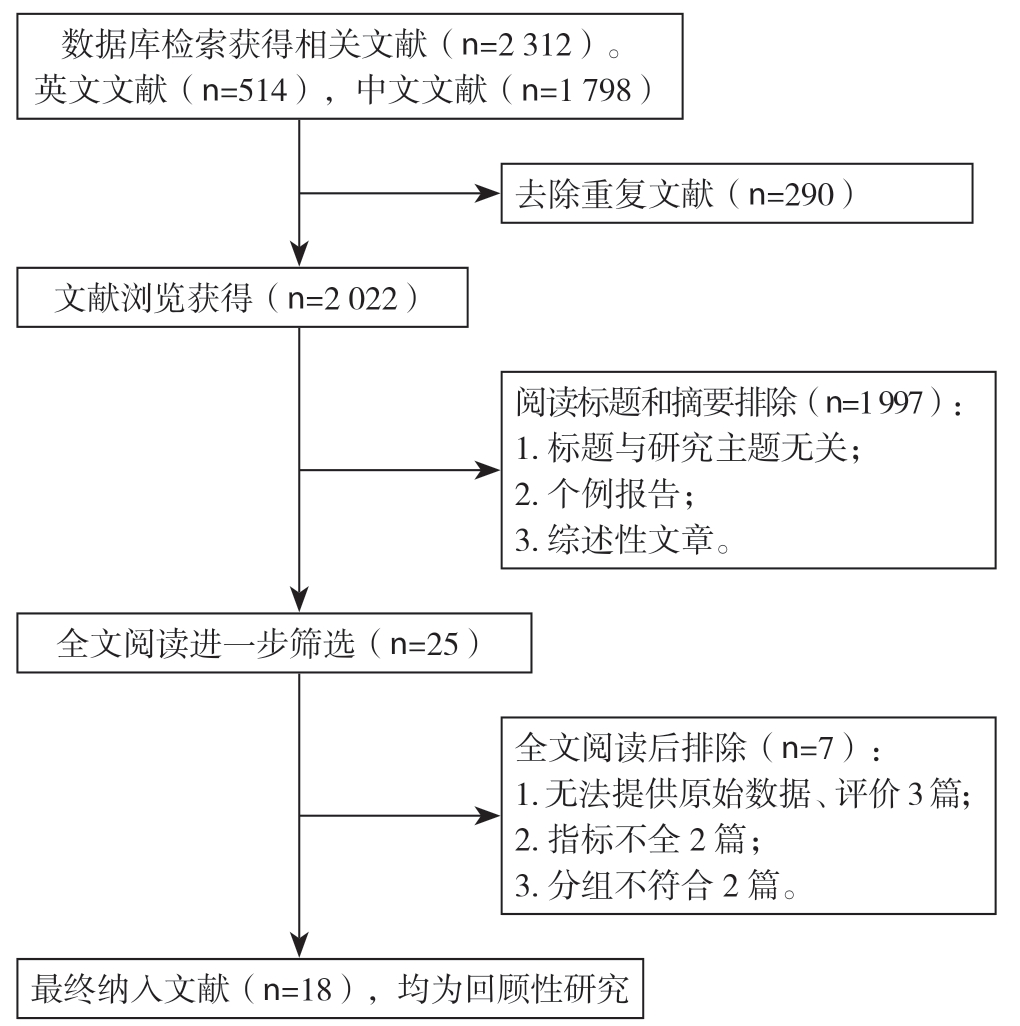
图1 文献检索流程图
Figure 1 Literature screening process
表1 纳入研究的基本特征及文献质量
Table 1 The general characteristics and quality of the included studies
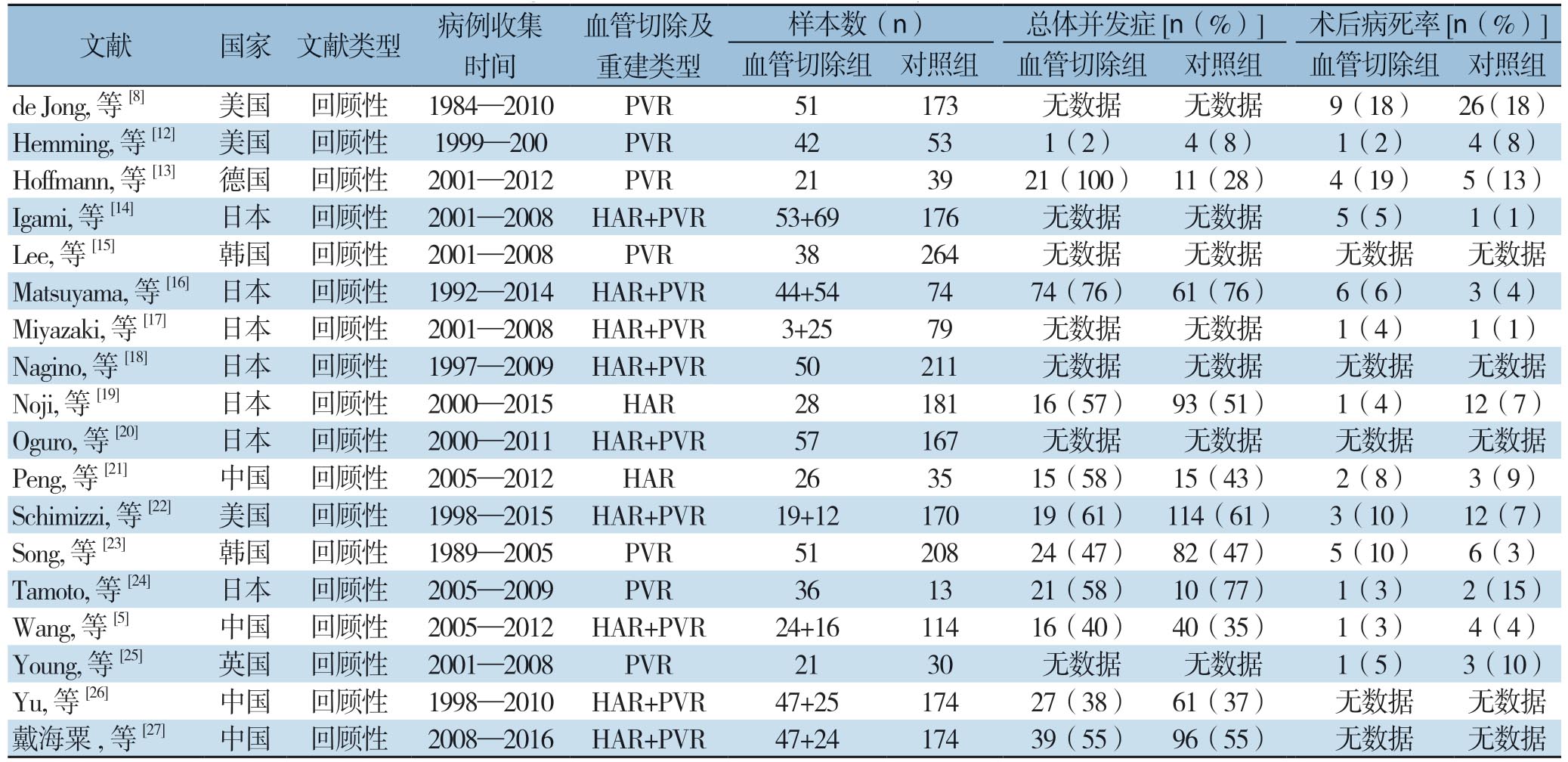
文献 国家 文献类型 病例收集时间血管切除及重建类型样本数(n) 总体并发症[n(%)] 术后病死率[n(%)]血管切除组 对照组 血管切除组 对照组 血管切除组 对照组de Jong, 等[8] 美国 回顾性 1984—2010 PVR 51 173 无数据 无数据 9(18) 26(18)Hemming, 等[12] 美国 回顾性 1999—200 PVR 42 53 1(2) 4(8) 1(2) 4(8)Hoffmann, 等[13] 德国 回顾性 2001—2012 PVR 21 39 21(100) 11(28) 4(19) 5(13)Igami, 等[14] 日本 回顾性 2001—2008 HAR+PVR 53+69 176 无数据 无数据 5(5) 1(1)Lee, 等[15] 韩国 回顾性 2001—2008 PVR 38 264 无数据 无数据 无数据 无数据Matsuyama, 等[16]日本 回顾性 1992—2014 HAR+PVR 44+54 74 74(76) 61(76) 6(6) 3(4)Miyazaki, 等[17] 日本 回顾性 2001—2008 HAR+PVR 3+25 79 无数据 无数据 1(4) 1(1)Nagino, 等[18] 日本 回顾性 1997—2009 HAR+PVR 50 211 无数据 无数据 无数据 无数据Noji, 等[19] 日本 回顾性 2000—2015 HAR 28 181 16(57) 93(51) 1(4) 12(7)Oguro, 等[20] 日本 回顾性 2000—2011 HAR+PVR 57 167 无数据 无数据 无数据 无数据Peng, 等[21] 中国 回顾性 2005—2012 HAR 26 35 15(58) 15(43) 2(8) 3(9)Schimizzi, 等[22] 美国 回顾性 1998—2015 HAR+PVR 19+12 170 19(61) 114(61) 3(10) 12(7)Song, 等[23] 韩国 回顾性 1989—2005 PVR 51 208 24(47) 82(47) 5(10) 6(3)Tamoto, 等[24] 日本 回顾性 2005—2009 PVR 36 13 21(58) 10(77) 1(3) 2(15)Wang, 等[5] 中国 回顾性 2005—2012 HAR+PVR 24+16 114 16(40) 40(35) 1(3) 4(4)Young, 等[25] 英国 回顾性 2001—2008 PVR 21 30 无数据 无数据 1(5) 3(10)Yu, 等[26] 中国 回顾性 1998—2010 HAR+PVR 47+25 174 27(38) 61(37) 无数据 无数据戴海粟,等[27] 中国 回顾性 2008—2016 HAR+PVR 47+24 174 39(55) 96(55) 无数据 无数据
表1 纳入研究的基本特征及文献质量(续)
Table 1 The general characteristics and quality of the included studies (continued)

文献 国家 文献类型 5年生存率[n(%)] R0 切除率[n(%)] 5年生存率[n(%)] NOS血管切除组 对照组 血管切除组 对照组 R0 R1 N0 N1 de Jong, 等[8] 美国 回顾性 17(33) 43(25) 51(26) 7(7) 51(26) 7(7) 45(27) 19(14) 7 Hemming, 等[12] 美国 回顾性 18(43) 23(43) 40(50) 0(0) 40(50) 0(0) 28(47) 8(23) 6 Hoffmann, 等[13] 德国 回顾性 4(19) 6(15) 11(30) 0(0) 11(30) 0(0) 无数据 无数据 7 Igami, 等[14] 日本 回顾性 7(6) 25(14) 102(52) 18(18) 102(52) 18(18) 8(5) 2(5) 6 Lee, 等[15] 韩国 回顾性 12(32) 110(42) 101(47) 9(10) 101(47) 9(10) 76(3) 5(7) 6 Matsuyama, 等[16]日本 回顾性 38(39) 34(46) 6(17) 2(22) 6(17) 2(22) 8(44) 2(8) 6 Miyazaki, 等[17] 日本 回顾性 无数据 无数据 21(33) 10(23) 21(33) 10(23) 4(12) 1(4) 5 Nagino, 等[18] 日本 回顾性 2(4) 34(16) 2(7) 0(0) 2(7) 0(0) 无数据 无数据 7 Noji, 等[19] 日本 回顾性 5(18) 48(27) 无数据 无数据 无数据 无数据 无数据 无数据 5 Oguro, 等[20] 日本 回顾性 12(21) 79(47) 80(50) 10(15) 80(50) 10(15) 72(60) 21(20) 6 Peng, 等[21] 中国 回顾性 8(31) 13(37) 无数据 无数据 无数据 无数据 无数据 无数据 6 Schimizzi, 等[22] 美国 回顾性 无数据 无数据 无数据 无数据 无数据 无数据 无数据 无数据 5 Song, 等[23] 韩国 回顾性 9(18) 56(27) 55(30) 61(15) 132(67) 61(15) 63(33) 2(3%) 7 Tamoto, 等[24] 日本 回顾性 5(14) 0(0) 无数据 无数据 无数据 无数据 无数据 无数据 7 Wang, 等[5] 中国 回顾性 10(25) 33(25) 40(29) 0(0) 40(29) 0(0) 40(40) 3(5) 7 Young, 等[25] 英国 回顾性 无数据 无数据 12(41) 1(5) 12(41) 1(5) 1(4) 1(4) 5 Yu, 等[26] 中国 回顾性 3(4) 37(21) 53(45) 11(22) 53(45) 11(22) 无数据 无数据 8戴海粟,等[27] 中国 回顾性 7(10) 24(14) 无数据 无数据 无数据 无数据 30(16) 0(0) 7
2.2 Meta 分析结果
2.2.1 术后总体并发症发生率 10 篇文 献[5, 13, 16, 19, 21-24, 26-27]报道了术后总体并发症发生率。分析结果显示:血管切除组和对照组术后总体并发症发生率分别为57.38%、49.66%,差异无统计学意义(OR=1.09,95% CI=0.78~1.54,P=0.61)(图2)。亚组分析结果表明,在术后总体并发症方面,肝动脉切除亚组和门静脉切除亚组发生率分别为59.56%、62.59%,各自对比对照组,无统计学差异(OR=1.18,95% CI=0.81~1.73,P=0.40;OR=1.18,95% CI=0.81~1.73,P=0.31)。 在 术后有关并发症,即血管并发症、肝衰竭、肝脓肿中,对比血管切除组和对照组,肝功能衰竭方面(发生率为12.93% 和17.54%),差异无统计学意义(OR=0.84,95% CI=0.56~1.24,P=0.36),血管并发症和肝脓肿方面(发生率分别为3.98%和0.16%、10.52% 和2.76%),存在统计学差异(OR=6.79,95% CI=2.16~21.38,P=0.01;OR=7.47,95% CI=2.63 ~21.18,P=0.01) (表2)。
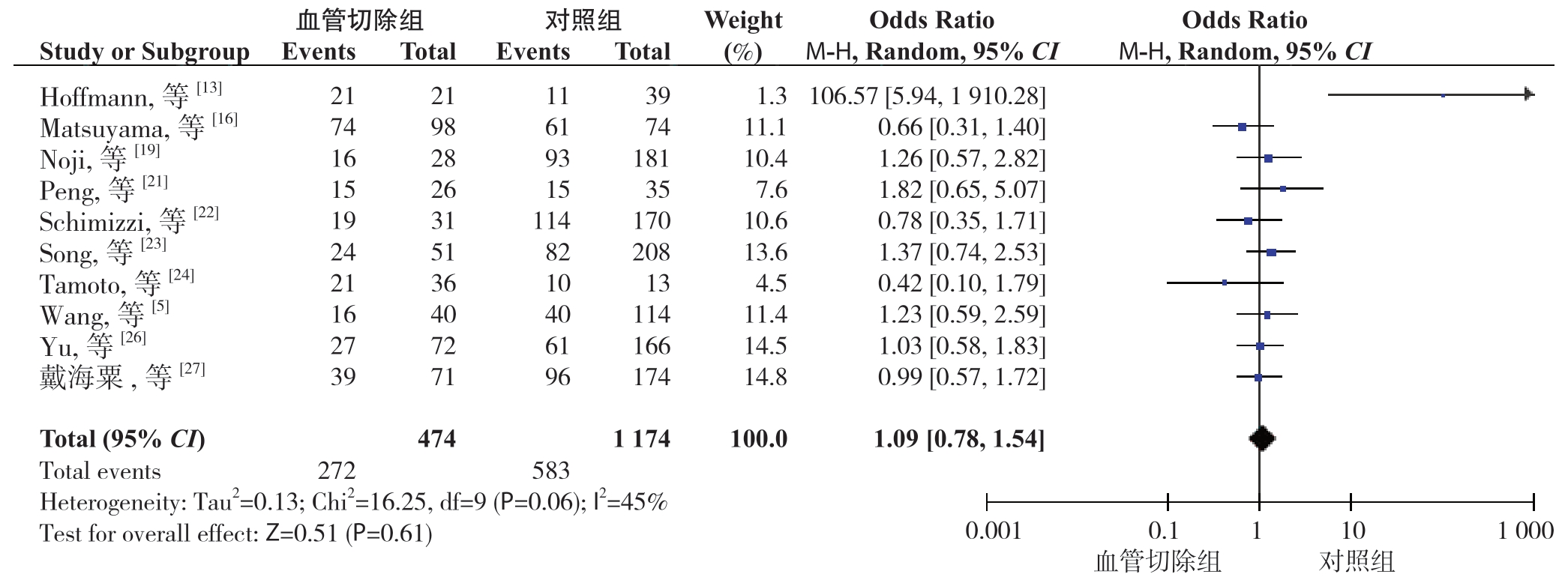
图2 血管切除组与对照组术后总体并发症发生率比较
Figure 2 Comparison of the incidence rates of overall postoperative complications between vascular resection group and control group
表2 术后总体并发症亚组分析
Table 2 Subgroup analysis of the overall postoperative complications
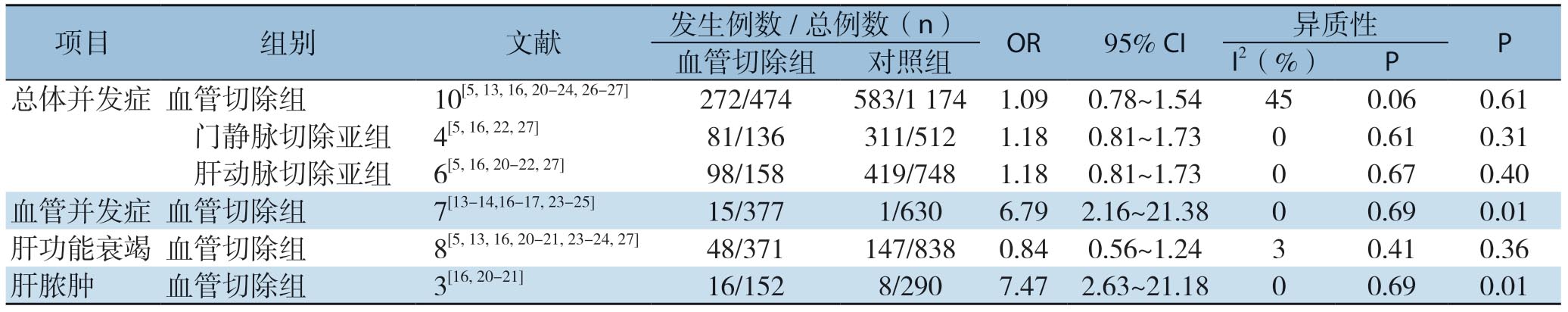
项目 组别 文献 发生例数/总例数(n) OR 95% CI 异质性 P血管切除组 对照组 I2(%) P总体并发症 血管切除组 10[5,13,16,20-24,26-27] 272/474 583/1 174 1.09 0.78~1.54 45 0.06 0.61 门静脉切除亚组 4[5,16,22,27] 81/136 311/512 1.18 0.81~1.73 0 0.61 0.31 肝动脉切除亚组 6[5,16,20-22,27] 98/158 419/748 1.18 0.81~1.73 0 0.67 0.40血管并发症 血管切除组 7[13-14,16-17,23-25] 15/377 1/630 6.79 2.16~21.38 0 0.69 0.01肝功能衰竭 血管切除组 8[5,13,16,20-21,23-24,27] 48/371 147/838 0.84 0.56~1.24 3 0.41 0.36肝脓肿 血管切除组 3[16,20-21] 16/152 8/290 7.47 2.63~21.18 0 0.69 0.01
2.2.2 术后病死率 13 篇文献[5,8,12-14,16-17,19,21-25]报道了术后病死率。分析结果显示:血管切除组和对照组术后病死率分别为7.23% 和7.60%,差异无统计学意义(OR=1.27,95% CI=0.84~1.93,P=0.25)(图3)。

图3 血管切除组与对照组术后病死率比较
Figure 3 Comparison of the mortality rates between vascular resection group and control group
2.2.3 1、3、5年总体生存率 分别有14篇[5,8,12-14,16,18-19,21-24,26-27]、15 篇[5,8,12-14,16,18-24,26-27]、 15篇文献[5,8,12-16,18-21,23-25,27]报道了第1、3、5年总体生存率。分析结果显示:血管切除组和对照组在第1、3、5年总体生存率分别为69.96%、33.04%、19.55% 和74.65%、40.16%、27.48%,差异均有统计学意义(OR=0.69,9 5% C I=0.5 6 ~0.8 5,P=0.0 1;O R=0.6 2, 9 5% C I=0.5 2 ~0.7 5,P=0.0 1;O R=0.6 1, 95% CI=0.49~0.76,P<0.000 1)。5年总体生存率比较见图4。亚组分析结果表明,在5年总体生存率方面,门静脉切除亚组对比对照组(5年生存率为25.30% 和26.74%)无统计学差异(OR=0.89,95% CI=0.68~1.17,P=0.42),肝动脉切除亚组对比对照组(5年生存率为13.75% 和23.06%),差异有统计学意义(OR=0.44,95% CI=0.30~0.67,P=0.01)(表3)。
2.2.4 R0切除率 6 篇文献[8,13,16,19,21,24] 报道了R0 切除率。分析结果显示:血管切除组和对照组的R0 切除率分别为74.62%、73.79%%,无统计学意义(OR=0.96,95% CI=0.66~1.40,P=0.84) (图5)。
2.2.5 R0与R1切除的5年生存率 13篇文献[5,8,12-18,20,23,26-27] 报道了R0 与R1 切除的5年生存率。分析结果显示:R0 切除组与R1 切除组的 5年生存率分别为38.68%、12.84%,差异有统计学意义(OR=4.38,95% CI=3.38~5.68,P=0.000 1) (图6)。
2.2.6 无淋巴结转移(N0)与淋巴结转移(N1)的5年生存率 11 篇文献[5,8,12,14-17,20,23,25,27]报道了N0 与N1 的5年生存率。分析结果显示,N0 组与N1 组的5年生存率分别为29.13%、9.05%,差异有统计学意义(OR=5.02,95% CI=3.15~7.99,P=0.000 1)(图7)。

图4 血管切除组与对照组5年总体生存率比较
Figure 4 Comparison of the 5-year survival rates between vascular resection group and control group
表3 5年总体生存率比较的分析亚组分析
Table 3 Subgroup analysis of the 5-year survival rates
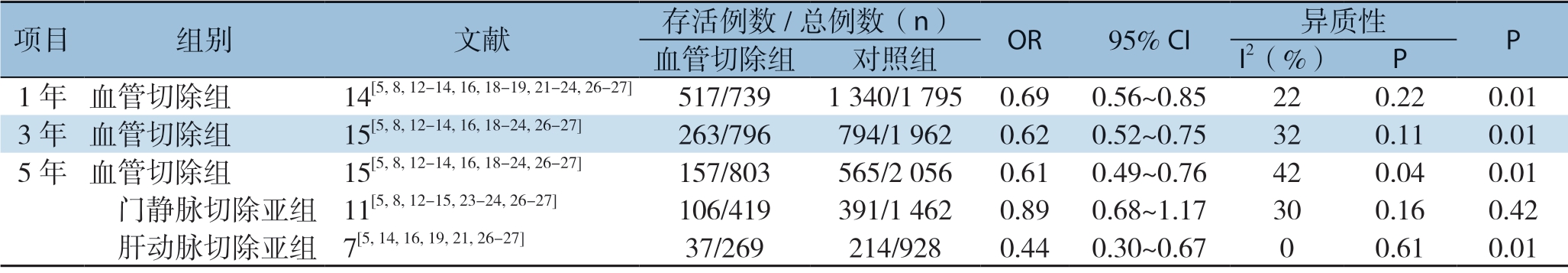
项目 组别 文献 存活例数/总例数(n) OR 95% CI 异质性 P 血管切除组 对照组 I2(%) P 1年 血管切除组 14[5,8,12-14,16,18-19,21-24,26-27] 517/739 1 340/1 795 0.69 0.56~0.85 22 0.22 0.01 3年 血管切除组 15[5,8,12-14,16,18-24,26-27] 263/796 794/1 962 0.62 0.52~0.75 32 0.11 0.01 5年 血管切除组 15[5,8,12-14,16,18-24,26-27] 157/803 565/2 056 0.61 0.49~0.76 42 0.04 0.01 门静脉切除亚组 11[5,8,12-15,23-24,26-27] 106/419 391/1 462 0.89 0.68~1.17 30 0.16 0.42 肝动脉切除亚组 7[5,14,16,19,21,26-27] 37/269 214/928 0.44 0.30~0.67 0 0.61 0.01
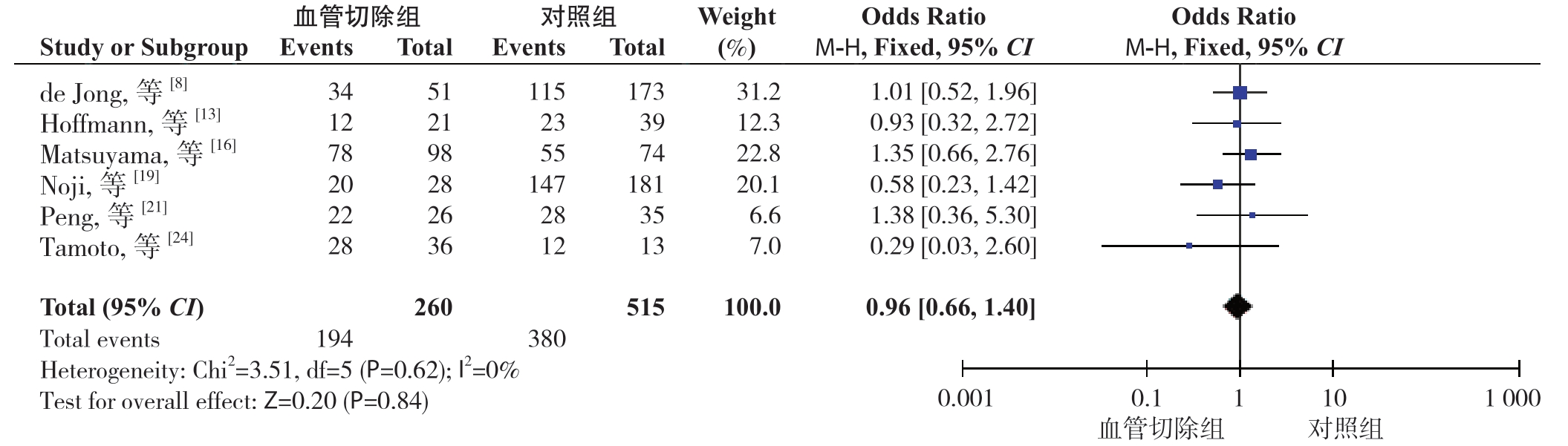
图5 血管切除组与对照组R0 切除率比较
Figure 5 Comparison of the R0 resection rates between vascular resection group and control group

图6 R0 切除组与R1 切除组5年生存率比较
Figure 6 Comparison of the 5-year survival rates between R0 resection group and R1 resection group

图7 N0 组与N1 组的5年生存率比较
Figure 7 Comparison of the 5-year survival rates between N0 group and N1 group
2.3 发表偏倚分析
发表偏倚进行漏斗图分析,由于血管切除组和对照组研究较多,最后选用纳入文献最多的 第3年总体生存率的比较分析,其结果显示如下:图示对称较好。其他效应指标Meta分析纳入的原始文献总数<10,故未发表偏倚(图8)。
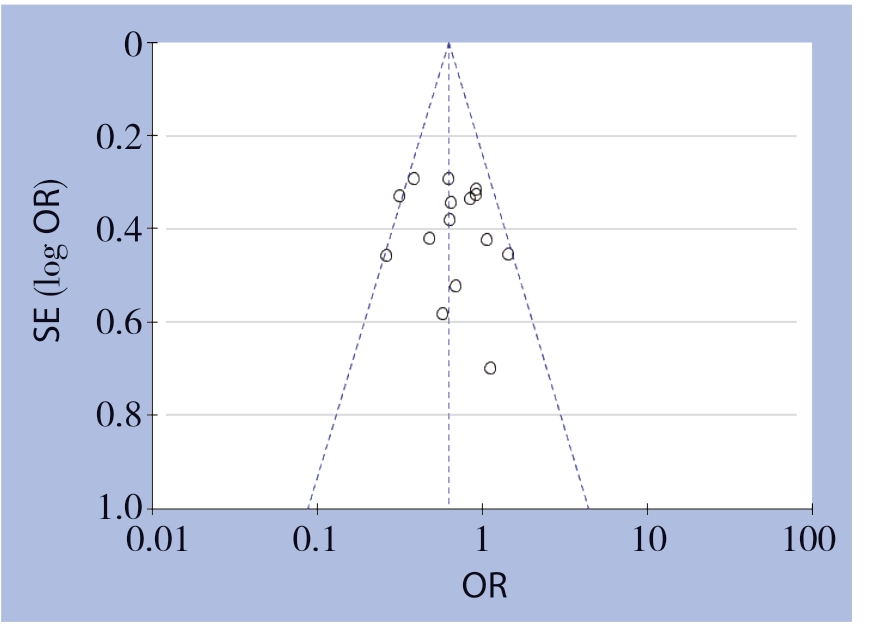
图8 血管切除组与对照组3年总体生存率的Meta 分析漏斗图
Figure 8 Funnel plot for Meta-analysis of the 3-year survival rates of vascular resection group and control group
3 讨 论
由于肝门部的复杂的解剖结构、胆管与肝门部血管及肝实质的相毗邻,肿瘤常常会侵犯到邻近的肝叶和血管,使得手术操作难度上升,术中难以达到阴性切缘,加之确诊HCCA的患者多半会存在血管浸润的情况,尤其是肝动脉的侵犯比例较高,所以HCCA的手术治疗是具有极大挑战。然而,随着手术技术和围手术期管理的改进,选择能够耐受该手术的患者进行血管切除和重建,为达到R0切除状态和同等的长期生存率提供了一种选择。目前联合血管切除及重建对具有血管侵犯的HCCA的患者的治疗方式被众多学者逐步的认可,但对于其所能带来的有关临床效果尚未达成明确共识。
3.1 联合血管切除及重建对HCCA 切除术安全性的影响
肝脏是体内以代谢功能为主的一个器官,而肝动脉及门静脉为肝脏提供大约30%~70%的血液供应量,一旦血管不合理切除重建将会导致肝组织缺血性损伤,就增加相关血管并发症(栓塞、狭窄、吻合口瘘)的发生率,影响手术治疗效果及其整体预后。联合血管切除及重建在理论上会增加手术风险和术后各项并发症的发生率及病死率。Matsuyama等[16]认为血管切除与重建有关常见的并发症,除了血管相关的并发症(栓塞、狭窄、吻合口瘘),还有肝衰竭和肝脓肿为代表。而Hoffmann[13]表示血管切除并不是病死率的独立预后因素。本研究结果表明:血管切除组在HCCA患者术后总并发症发生率及病死率方面基本一致,无统计学差异。亚组分析结果表明:门静脉切除亚组也未明显增加HCCA患者术后总并发症发生率。肝动脉切除亚组在术后并发症发生率较对照组高,但无统计学意义。术后相关并发症肝衰竭、血管并发症、肝脓肿发生率比较,前者差异无统计学意义,后两者存在统计学差异。血管并发症与肝脓肿在联合血管切除后发生率较高。可能与纳入的文献样本、血管重建后对肝脏血供或部分肝叶切除等的影响有关。联合血管切除在总体安全性上还是较好的。研究[28]认为由于近年血管外科的快速发展,针对肝动脉、门静脉等血管吻合成熟度较高,尤其是切取自体血管实施重建等,重建后的阻塞率较前明显降低。故准确评估肝功能,严格评估肝体积,完善的术前准备和手术流程并结合个性化的治疗方案是减少术后并发症及病死率的关键。
3.2 联合血管切除及重建对HCCA 近远期疗效、切除有效性的影响
本研究结果表明:血管切除组在第1、3、 5年总体生存率方面较对照组差。亚组分析结果表明:对比对照组,肝动脉切除亚组在第5年总体生存率结果不佳,而门静脉切除亚组则无明显差异。血管切除组表现不佳,应该主要归因于选择偏倚。血管切除组多为进展期HCCA患者,尤其是肝动脉切除亚组,多半为Bismuth III、IV型,中晚期比例较高,而手术方面,这部分患者联合血管切除率高,达81%~97%[14,29]。尽管联合血管切除提高了HCCA的切除率,但由于该组患者淋巴结转移率高,肿瘤恶性程度高所致侵袭转移能力强,导致总体生存率较低[27]。这可以解释血管切除组在R0切除率差异不大的情况下,1、3、5年的总体生存率却低于对照组。研究[29]显示,虽然联合肝动脉切除的患者在总体生存时间方面,不如行传统根治或门静脉切除重建的患者,但高于姑息手术组,较之可以延长约13个月的生存时间,与未接受手术切除的患者相比,R1的患者具有一定生存优势。故对HCCA患者实行常规手术治疗,甚至为达R0切除的联合血管的治疗,虽带来一定手术的风险,同时也带来较好临床效果的预后。
对比对照组,血管切除组在R0切除率上保持一致。而联合血管切除重建对R0切除率的提升是有一定作用的,使部分原本无法获得手术机会的患者从中获益。故联合血管切除及重建对HCCA在手术治疗方面是可以让患者从中受益,尤其是Bismuth III、IV型的患者。虽然血管切除组在5年总体生存率较低,但在R0的切除率,与传统根治术一致,是能够提升这部分患者生存时间。同时也有研究表示包括血管切除和重建在内的整体切除可以通过no touch技术进行切除,这可能会减少肿瘤细胞的脱落和微栓塞,并通过联合血管的切除可以提高生存率[18,30-31]。Abbas等[32]认为了对比非血管切除,联合门静脉切除重建的患者并没有明显生存优势,也在R0切除率方面的保持一致,而关于门静脉切除的有效性已得到很好的证实,相对姑息性切除,门静脉切除有可能提高长期生存率。与本研究结果相符。
3.3 R0 与R1 切除、N0 与N1 对肝门部胆胆管癌远期疗效的影响
本研究结果表明:对比R1组,R0组在5年生存率方面较高;HCCA根治性阴性切除边缘是影响长期预后的重要独立危险因素[33-36]。也有学者[31]认为HCCA患者的预后跟R0切除、淋巴结转移、神经筋膜浸润密切联系。Hidalgo等[37]等研究显示R0、R1切除HCCA的1、3、5年生存率分别为7 8%、64%、45%和60%、26%、26%,Hoffmann等[13]认为单纯根治术患者和合并门静脉切除患者根治术的R0切除率和淋巴结清扫率相似。
对比N1,N0组在5年生存率方面较高。研究[38-41]认为,淋巴结转移是影响HCCA术后生存时间的重要因素,淋巴结转移的组别较无淋巴结转移的组别预后较差。本研究R0组与N0组生存率较高的结果跟前者结论较为贴合。
综上所述,HCCA根治性手术切除仍是HCCA患者获得较好预后的唯一治疗方法,HCCA根治术联合血管切除及重建是总体可行的,可以提高R0切除率,改善患者预后。当合并门静脉侵犯时,可以行联合血管的R0切除不增加其术后并发症发生率及病死率,也不会恶化预后。当合并肝动脉侵犯是手术R0切除的唯一障碍时,不能简单地将其作为根治性手术的禁忌证,可以手术治疗,但需慎重处理,目的使患者获益。本研究纳入的均为回顾性研究,由于各个研究类型的不同、术者水平的差异以及纳入文献的异质性,因此,有待大样本、多中心、前瞻性随机对照研究近一步验证。
[1] Klatskin G.Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis.an unusual tumor with distinctive clinical and pathological features[J].Am J Med, 1965, 38:241-256.doi: 10.1016/0002-9343(65)90178-6.
[2] Nagino M, Ebata T, Yokoyama Y et al.Evolution of surgical treatment for perihilar cholangiocarcinoma: a single-center 34-year review of 574 consecutive resections[J].Ann Surg, 2013, 258(1):129-140.doi: 10.1097/SLA.0b013e3182708b57.
[3] Ebata T, Yokoyama Y, Igami T et al.Hepatopancreatoduodenectomy for cholangiocarcinoma: a single-center review of 85 consecutive patients[J].Ann Surg, 2012, 256(2):297-305.doi: 10.1097/SLA.0b013e31826029ca.
[4] Kajitani T, Kuno K, Hishida Y, et al.Surgery of bile duct cancer at the porta hepatis[J].Shujutsu, 1966, 20(11):997-1002.
[5] Wang ST, Shen SL, Peng BG, et al.Combined vascular resection and analysis of prognostic factors for hilar cholangiocarcinoma[J].Hepatobiliary Pancreat Dis Int, 2015, 14(6):626-632.doi: 10.1016/s1499-3872(15)60025-x.
[6] 晏益核, 黄玉斌, 蔡小勇.肝门部胆管癌的外科治疗现状[J].中国普通外科杂志, 2017, 26(2):246-251.doi:10.3978/j.issn.1005-6947.2017.02.019.
Yan YH, Huang YB, Cai XY.Current status in surgical management of hilar holangiocarcinoma[J].Chinese Journal of General Surgery, 2017, 26(2):246-251.doi:10.3978/j.issn.1005-6947.2017.02.019.
[7] 李相成, 冯勤超.肝门部胆管癌的进展与争议[J].临床肝胆病杂志, 2019, 35(12):2632-2637.doi:10.3969/j.issn.1001-5256.2019.12.004.
Li XC, Feng QC.Advance and controversy of hilar cholangiocarcinoma[J].Journal of Clinical Hepatology, 2019, 35(12):2632-2637.doi:10.3969/j.issn.1001-5256.2019.12.004.
[8] de Jong MC, Marques H, Clary BM, et al.The impact of portal vein resection on outcomes for hilar cholangiocarcinoma: a multiinstitutional analysis of 305 cases[J].Cancer, 2012, 118(19):4737-4747.doi: 10.1002/cncr.27492.
[9] 施宝民, 卢晓飞, 孙小刚, 等.无瘤原则下扩大半肝及门静脉切除术: 肝门部胆管癌欧洲外科新动向[J].中国现代普通外科进展, 2010, 13(6):461-465.doi:10.3969/j.issn.1009-9905.2010.06.014.
Shi BM, Lu XF, Sun XG, et al.Extended hemiheatectomy and portal vein resection under non-touch principle: new development of surgery for hilar cholangiocarcinoma in Europe[J].Chinese Journal of Current Advances in General Surgery, 2010, 13(6):461-465.doi:10.3969/j.issn.1009-9905.2010.06.014.
[10] Wu XS, Dong P, Gu J, et al.Combined portal vein resection for hilar cholangiocarcinoma: a meta-analysis of comparative studies[J].J Gastrointest Surg, 2013, 17(6):1107-1115.doi: 10.1007/s11605-013-2202-9.
[11] Chen W, Ke K, Chen YL.Combined portal vein resection in the treatment of hilar cholangiocarcinoma: a systematic review and meta-analysis[J].Eur J Surg Oncol, 2014, 40(5):489-495.doi: 10.1016/j.ejso.2014.02.231.
[12] Hemming AW, Mekeel K, Khanna A, et al.Portal vein resection in management of hilar cholangiocarcinoma[J].J Am Coll Surg, 2011, 212(4):604-613.doi: 10.1016/j.jamcollsurg.2010.12.028.
[13] Hoffmann K, Luible S, Goeppert B, et al.Impact of portal vein resection on oncologic long-term outcome in patients with hilar cholangiocarcinoma[J].Surgery, 2015, 158(5):1252-1260.doi: 10.1016/j.surg.2015.04.032.
[14] Igami T, Nishio H, Ebata T, et al.Surgical treatment of hilar cholangiocarcinoma in the "new era": the Nagoya University experience[J].J Hepatobiliary Pancreat Sci, 2010, 17(4):449-454.doi: 10.1007/s00534-009-0209-0.
[15] Lee SG, Song GW, Hwang S, et al.Surgical treatment of hilar cholangiocarcinoma in the new era: the Asan experience[J].J Hepatobiliary Pancreat Sci, 2010, 17(4):476-489.doi: 10.1007/s00534-009-0204-5.
[16] Matsuyama R, Mori R, Ota Y, et al.Significance of Vascular Resection and Reconstruction in Surgery for Hilar Cholangiocarcinoma: With Special Reference to Hepatic Arterial Resection and Reconstruction[J].Ann Surg Oncol, 2016, 23(Suppl 4):475-484.doi: 10.1245/s10434-016-5381-2.
[17] Miyazaki M, Kimura F, Shimizu H, et al.One hundred seven consecutive surgical resections for hilar cholangiocarcinoma of Bismuth types II, III, IV between 2001 and 2008[J].J Hepatobiliary Pancreat Sci, 2010, 17(4):470-475.doi: 10.1007/s00534-009-0207-2.
[18] Nagino M, Nimura Y, Nishio H, et al.Hepatectomy with simultaneous resection of the portal vein and hepatic artery for advanced perihilar cholangiocarcinoma: an audit of 50 consecutive cases[J].Ann Surg, 2010, 252(1):115-123.doi: 10.1097/SLA.0b013e3181e463a7.
[19] Noji T, Tsuchikawa T, Okamura K, et al., Concomitant hepatic artery resection for advanced perihilar cholangiocarcinoma: a case-control study with propensity score matching[J].J Hepatobiliary Pancreat Sci, 2016, 23(7):442-448.doi: 10.1002/jhbp.363.
[20] Oguro S, Esaki M, Kishi Y, et al.Optimal indications for additional resection of the invasive cancer-positive proximal bile duct margin in cases of advanced perihilar cholangiocarcinoma[J].Ann Surg Oncol, 2015, 22(6):1915-1924.doi: 10.1245/s10434-014-4232-2.
[21] Peng C, Li C, Wen T, et al.Left hepatectomy combined with hepatic artery resection for hilar cholangiocarcinoma: A retrospective cohort study[J].Int J Surg, 2016, 32:167-173.doi: 10.1016/j.ijsu.2016.06.038.
[22] Schimizzi GV, Jin LX, Davidson JT 4th, et al.Outcomes after vascular resection during curative-intent resection for hilar cholangiocarcinoma: a multi-institution study from the US extrahepatic biliary malignancy consortium[J].HPB (Oxford), 2018, 20(4):332-339.doi: 10.1016/j.hpb.2017.10.003.
[23] Song GW, Lee SG, Hwang S, et al.Does portal vein resection with hepatectomy improve survival in locally advanced hilar cholangiocarcinoma?[J].Hepatogastroenterology, 2009, 56(93):935-942.
[24] Tamoto E, Hirano S, Tsuchikawa T, et al.Portal vein resection using the no-touch technique with a hepatectomy for hilar cholangiocarcinoma[J].HPB (Oxford), 2014, 16(1):56-61.doi: 10.1111/hpb.12067.
[25] Young AL, Prasad KR, Toogood GJ, et al.Surgical treatment of hilar cholangiocarcinoma in a new era: comparison among leading Eastern and Western centers, Leeds[J].J Hepatobiliary Pancreat Sci, 2010, 17(4):497-504.doi: 10.1007/s00534-009-0203-6.
[26] Yu W, Shao M, Gu Z, et al.Effect evaluation of vascular resection for patients with hilar cholangiocarcinoma: original data and metaanalysis[J].Hepatogastroenterology, 2014, 61(130):307-313.
[27] 戴海粟, 别平, 王曙光, 等.联合肝动脉切除重建在肝门部胆管癌根治术中的临床研究[J].中华外科杂志, 2018, 56(1):41-46.doi:10.3760/cma.j.issn.0529-5815.2018.01.010.
Dai HS, Bie P, Wang SG, et al.Clinical application of combined hepatic artery resection and reconstruction in surgical treatment for hilar cholangiocarcinoma[J].Chinese Journal of Surgery, 2018, 56(1):41-46.doi:10.3760/cma.j.issn.0529-5815.2018.01.010.
[28] 周桂华, 夏红天, 刘博, 等.血管切除重建技术在肝脏肿瘤合并下腔静脉侵犯外科治疗中的应用[J].中华肝胆外科杂志, 2016, 22(2):127-129.doi:10.3760/cma.j.issn.1007-8118.2016.02.016.
Zhou GH, Xia HT, Liu B, et al.Application of vascular resection and reconstruction in treatment of liver cancer with inferior vena cava involvement[J].Chinese Journal of Hepatobiliary Surgery, 2016, 22(2):127-129.doi:10.3760/cma.j.issn.1007-8118.2016.02.016.
[29] Mittal B, Deutsch M, Iwatsuki S.Primary cancers of extrahepatic biliary passages [J].Int J Radiat Oncol Biol Phys, 1985, 11(4):849-854.doi: 10.1016/0360-3016(85)90320-7.
[30] Neuhaus P, Jonas S, Bechstein WO, et al.Extended resections for hilar cholangiocarcinoma[J].Ann Surg, 1999, 230(6):808-818.doi: 10.1097/00000658-199912000-00010.
[31] Klempnauer J, Ridder GJ, von Wasielewski R, et al.Resectional surgery of hilar cholangiocarcinoma: a multivariate analysis of prognostic factors[J].J Clin Oncol, 1997, 15(3):947-954.doi: 10.1200/JCO.1997.15.3.947.
[32] Abbas S, Sandroussi C.Systematic review and meta-analysis of the role of vascular resection in the treatment of hilar cholangiocarcinoma [J].HPB (Oxford), 2013, 15(7):492-503.doi: 10.1111/j.1477-2574.2012.00616.x.
[33] Soares KC, David IK, 冯铁成(译), 等.肝门部胆管癌的诊断、治疗选择与处理策略[J].中国普通外科杂志, 2014, 23(8):1011-1023.doi:10.7659/j.issn.1005-6947.2014.08.001.
Soares KC, David IK, Feng TC, et al.Hilar cholangiocarcinoma: diagnosis, treatment options,and management[J].Chinese Journal of General Surgery, 2014, 23(8):1011-1023.doi:10.7659/j.issn.1005-6947.2014.08.001.
[34] Burke EC, Jarnagin WR, Hochwald SN, et al.Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system[J].Ann Surg, 1998, 228(3):385-394.doi: 10.1097/00000658-199809000-00011.
[35] Pichlmayr R, Weimann A, Klempnauer J, et al.Surgical treatment in proximal bile duct cancer.A single-center experience[J].Ann Surg, 1996, 224(5):628-638.doi: 10.1097/00000658-199611000-00007.
[36] Nimura Y, Kamiya J, Kondo S, et al.Aggressive preoperative management and extended surgery for hilar cholangiocarcinoma: Nagoya experience[J].J Hepatobiliary Pancreat Surg, 2000, 7(2):155-162.doi: 10.1007/s005340050170.
[37] Hidalgo E, Asthana S, Nishio H, et al.Surgery for hilar cholangiocarcinoma: the Leeds experience[J].Eur J Surg Oncol, 2008, 34(7):787-794.doi: 10.1016/j.ejso.2007.10.005.
[38] Murakami Y, Uemura K, Sudo T, et al.Prognostic factors after surgical resection for intrahepatic, hilar, and distal cholangiocarcinoma[J].Ann Surg Oncol, 2011, 18(3):651-658.doi: 10.1245/s10434-010-1325-4.
[39] Buettner S, Margonis GA, Kim Y, et al.Conditional probability of long-term survival after resection of hilar cholangiocarcinoma[J].HPB (Oxford), 2016, 18(6):510-517.doi: 10.1016/j.hpb.2016.04.001.
[40] Giuliante F, Ardito F, Guglielmi A, et al.Association of Lymph Node Status With Survival in Patients After Liver Resection for Hilar Cholangiocarcinoma in an Italian Multicenter Analysis[J].JAMA Surg, 2016, 151(10):916-922.doi: 10.1001/jamasurg.2016.1769.
[41] 张耀东, 李相成.合并血管切除重建的肝门部胆管癌根治术[J].中华肝胆外科杂志, 2018, 24(2):135-139.doi:10.3760/cma.j.issn.1007-8118.2018.02.020.
Zhang YD, Li XC.Vascular resection and reconstruction for hilar cholangiocarcinoma[J].Chinese Journal of Hepatobiliary Surgery, 2018, 24(2):135-139.doi:10.3760/cma.j.issn.1007-8118.2018.02.020.
