肝细胞癌(HCC)是全球第二大常见的癌症死亡原因,其发病率正逐步上升[1]。我国作为病毒性肝炎的高发国家,具有较高的HCC发病率,每年因HCC 死亡人数占全世界肝癌死亡人数的45.0%[2],严重威胁着患者的生命健康。肝切除术被认为是HCC的一线治疗方法,但肝切除术后的复发率相对较高,5年内累计复发率为>60%[3]。因此,如何提高复发病灶再次治疗质量是提高复发性HCC患者远期生存率的关键。目前,对于肝切除术后复发性HCC的治疗尚无明确的临床指南。肝移植是理论上认为是复发性HCC的最佳选择,因为它消除了肿瘤复发和肝硬化,但由于捐献器官的短缺、成本高、移植等待时间长、术后病死率和发病率高等原因使其临床实践运用被极大的限制[4]。重复肝切除也被报道为治疗复发性HCC的有效方法,但由于肝体积小、肝功能储备差、肿瘤复发多、术后粘连等原因,仅有20%的复发性HCC患者适合重复肝切除[5]。对复发性HCC,手术切除、经导管动脉化疗栓塞(TACE)、局部消融是有效的治疗方法[6]。回顾性研究表明,经皮微波消融(PMCT)对于改善单发小HCC患者的1、3、5年的总体生存率(OS)与无病生存率(RFS)方面无明显优势,且PMCT的远期疗效与手术相当[7-9]。与单纯TACE比较,TACE与PMCT联合治疗大HCC患者具有更高的肿瘤坏死率和更长的生存期[10-12]。然而,TACE联合PMCT与TACE治疗复发性HCC的疗效优劣尚未见报道。因此,本研究通过回顾性分析,比较TACE联合PMCT与单纯TACE治疗复发性HCC的远期疗效。
1 资料与方法
1.1 临床资料
2007年1月—2019年1月共收治1367例的HCC患者,均在我院行首次肝切除术。根据纳入标准,选择530例复发患者纳入本研究,其中161例接受TACE+PMCT,369例仅接受TACE。纳入标准:⑴ 患者首次肝切除术在西南医科大学附属医院进行,术后病理确诊为HCC;⑵ 复发患者仅接受了TACE联合PMCT治疗或TACE术。由于高龄、严重肝硬化、病灶位置或患者及家属主观等因素未再次行手术治疗;缺乏完整的临床及随访资料的患者予以排除。本回顾性研究按照《2013年赫尔辛基宣言》及国家和国际准则进行,经医院伦理审查委员会批准。
1.2 治疗方法
所有患者均行TACE治疗。采用Seldinger技术,经股动脉行肝总动脉或肝固有动脉置管,评估肿瘤的位置、数量、大小及血供。随后将微导管插入肝叶或肝段动脉分支,经导管进行化疗栓塞。化疗药物为氟尿嘧啶、奥沙利铂,在DSA监视下缓慢灌注栓塞剂碘化油,对肿瘤供血动脉、肿瘤内微血管进行栓塞,直到供应肿瘤的动脉血流完全阻断。TACE术后1~3周行PMCT治疗。微波治疗装置ECO-100用于治疗组织间肿瘤。用2%利多卡因麻醉穿刺部位后,在超声引导下将微波针经皮肝组织刺入瘤灶中,穿刺时避开空腔脏器(胆囊、胃肠道等)及大血管。开启冷循环,根据肿瘤大小及血供情况调节消融时间及输出功率,功率一般为40~60 W,消融时间为5~10 min,热凝范围超过瘤体边缘0.5 cm以上。消融针退出时升温灼烧针道。根据肿瘤情况的不同,对≤3 cm的肿瘤 1针原位消融,对3~5 cm的肿瘤根据肿瘤形态行1~2针消融。经TACE、PMCT治疗后,给予保肝、抗炎、镇静治疗。
1.3 随访
术后1年,每3 个月随访1 次,此后每6 个月随访1次,所有患者随访截止日期至2019年1月或患者死亡时。复查指标包括:肝功能、凝血酶原时间(PT)、甲胎蛋白(AFP)、腹部超声、胸片、增强CT或磁共振成像,根据典型的影像学表现诊断肿瘤复发情况。
1.4 统计学处理
主要研究终点是两组患者术后的OS及RFS。使用χ2检验或Fisher精确检验(2尾)评估分类数据差异的显著性。生存分析采用Kaplan-Meier法和Log-rank检验。采用Cox比例风险模型进行单因素和多因素分析,以显示独立的预后影响因素。分类变量表示为频率[n(%)]。生存分析结果描述为风险比(HR)和95%置信区间(CI)。所有报告的P值均为双侧,P<0.05为差异有统计学意义。采用SPSS 24.0进行统计分析。
2 结 果
2.1 两组HCC 复发患者的基线资料
530例术后复发患者的基线资料详见表1,其中R0切除与分化程度根据首次肝切除术后的病理及免疫组化结果。两组患者的性别、年龄、合并症、肝硬化、丙氨酸氨基转移酶(ALT)、AFP、白蛋白(ALB)、PT、R0切除、分化程度、肿瘤部位、肿瘤直径无统计学差异(均P>0.05),但两组患者在病原学(P=0.009)、切除术后到复发治疗时间(P<0.001)、肿瘤直径(P=0.005)差异有统计学意义(表1)。采用倾向得分匹配(PSM)对观察组161 例患者与对照组369 例患者以1:1的比例配对,从两组患者中匹配出150对患者。PSM后两组基线特征均无统计学差异(均P>0.05)(表2)。
2.2 两组HCC 复发患者治疗后的生存情况
患者的中位随访时间为24.5 个月。观察组150例中86例(57.3%)死亡,105例(70.0%)复发;对照组150 例中112 例(74.7%)死亡,127例(84.7%)复发。观察组与对照组患者中位OS时间分别为43.1、19.0个月;中位RFS时间分别为36.0、16.7个月,差异均有统计学意义(P=0.001、P=0.002)(图1)。两组患者1、2年OS和RFS差异无统计学意义(均P>0.05),但观察组3、4、5年OS及RFS均明显优于对照组(均P<0.05)(表3)。
表1 两组复发性HCC 患者临床病理资料比较[n(%)]
Table1 Comparison of the clinicopathologic data between the two groups of patients with recurrent HCC [n (%)]

资料 n 观察组(n=161)对照组(n=369) P年龄(岁) <5023178(48.4) 153(41.5) 0.153 ≥5029983(51.6) 216(58.5)性别 男 461136(84.5) 325(88.1) 0.264 女 6925(15.5) 44(11.9)合并症 高血压病 13145(27.9) 86(23.3)0.338 糖尿病 5218(11.1) 34(9.2) 其他 34798(60.8) 249(67.4)病原学 HBV 436142(88.2) 294(79.7) 0.019 其他 9419(11.8) 75(20.3)肝硬化 有 12345(28.0) 78(21.1) 0.250 无 407116(72.0) 291(78.9)血清生化 ALT(100 U/L) ≥100385(3.1) 33(8.9) 0.170 <100492156(96.9) 336(91.1) AFP(μg/L) ≥40016945(28.0) 124(33.6) 0.224 <400361116(72.0) 245(66.4) ALB(g/L) ≥35502152(94.4) 350(94.9) 0.835 <35289(5.6) 19(4.1) PT(s) ≥14327(4.3) 25(6.8) 0.327 <14498154(95.7) 344(93.2)切除术后到复发时间(月) <1226347(29.2) 216(58.5)<0.00112~2416865(40.4) 103(27.9) >24~369949(30.4) 50(13.6)R0 切除 是 516159(98.8) 357(96.7) 0.246 否 142(1.2) 12(3.3)分化程度 高 296(3.7) 23(6.2)0.422 中 343109(67.7) 234(63.4) 低 15846(28.6) 112(30.4)肿瘤部位 左叶 10629(18.0) 77(20.9) 右叶 346112(69.6) 234(63.4) 左叶+右叶 6716(9.9) 51(13.8) 尾状叶 114(2.5) 7(1.9)肿瘤直径(cm) <323586(53.4) 149(40.4) 0.0053~529575(46.6) 220(59.6)肿瘤数目(个) <39722(13.7) 75(20.3) 0.087 ≥3433139(86.3) 294(79.7)0.452
表2 PSM后两组复发性HCC患者临床病理资料比较[n(%)]
Table2 Comparison of the clinicopathologic data between the two groups of patients with recurrent HCC after PSM [n (%)]

资料 n 观察组(n=150)对照组(n=150) P年龄(岁) <5013472(48.0) 62(41.3) 0.292 ≥5016678(52.0) 88(58.7)性别 男 257127(84.7) 130(86.7) 0.742 女 4323(15.3) 20(13.3)合并症 高血压病 3519(12.6) 16(10.6)0.805 糖尿病 8846(30.6) 48(32.0) 其他 19797(64.6) 100(66.6)病原学 HBV 256131(87.3) 125(83.3) 0.415 其他 4419(12.7) 25(16.7)肝硬化 有 7940(26.7) 39(26.0) 0.897 无 221110(73.3) 111(74.0)血清生化 ALT(100 U/L) ≥100165(3.3) 11(7.3) 0.198 <100284145(96.7) 139(92.7) AFP(μg/L) ≥4008239(26.0) 43(28.7) 0.698 <400218111(74.0) 107(71.3) ALB(g/L) ≥35288143(95.3) 145(96.7) 0.770 <35127(4.7) 5(3.3) PT(s) ≥14166(4.0) 10(6.7) 0.442 <14284144(96.0) 140(93.3)切除术后到复发时间(月) 0~1210247(31.3) 55(36.7)0.21412~2412359(39.3) 64(42.7) 24~367544(29.3) 31(20.7)R0 切除 是 296148(98.7) 148(98.7) 1 否 42(1.3) 2(1.3)分化程度 高 136(4.0) 7(4.7)0.937 中 205102(68) 103(68.7) 低 8242(28) 40(26.7)肿瘤部位 左叶 5427(18) 27(18) 右叶 207104(69.3) 103(68.7) 左叶+右叶 3416(10.7) 18(12) 尾状叶 53(2.0) 2(1.3)肿瘤直径(cm) <315478(52.0) 76(50.7) 0.9083~514672(48.0) 74(49.3)肿瘤数目(个) <34722(14.3) 25(16.7) 0.751 ≥3253128(85.3) 125(83.3)0.956
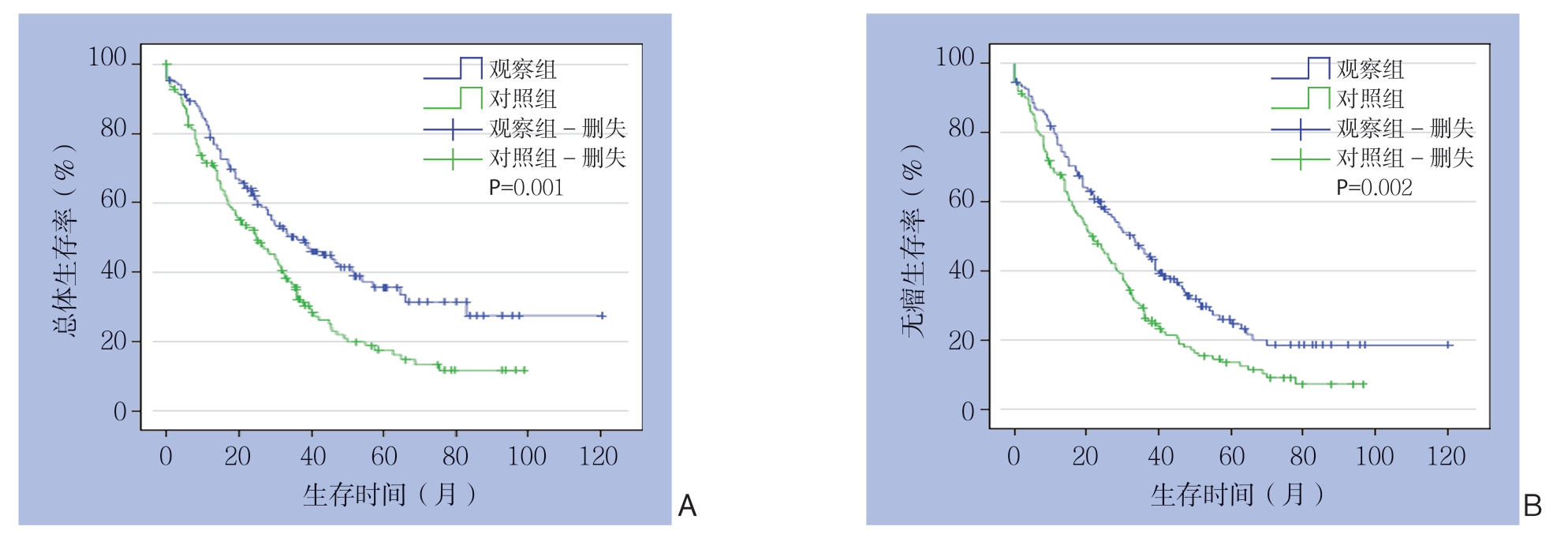
图1 两组对复发性HCC 患者生存曲线
Figure1 Survival curves of the two groups of patients with recurrent HCC
A:OS 曲线;B:RFS 曲线
A:OS curves; B:RFS curves
表3 两组患者OS 与RFS 比较(%)
Table3 Comparison of OS and RFS rates between the two groups of patients (%)

组别 OS RFS 1年 2年 3年 4年 5年 1年 2年 3年 4年 5年观察组(n=161) 78.861.149.441.535.676.558.745.033.024.7对照组(n=369) 71.452.133.122.017.668.547.228.718.113.7 χ2 1.7011.6435.9528.3618.2161.5802.8956.2375.9244.673 P 0.2530.2540.0210.0060.0060.2700.1190.0180.0230.046
2.3 影响复发性HCC 患者预后的因素分析
多因素分析显示, TACE + PMCT(H R=1.473,95% C I=1.094 ~1.983,P=0.011),肝硬化(H R=1.101,95% C I= 1.041 ~1.165,P=0.001)是O S 的独立影响因素(表4);TACE+PMCT(H R=1.093,95% CI=1.037~1.151,P=0.001)和分化程度(HR=1.445,95% CI=1.135~1.840,P=0.003)是RFS的独立影响因素(表5)。
表4 复发性HCC 患者OS 的单因素与多因素分析
Table4 Univariate and multivariate analysis of OS in patients with recurrent HCC
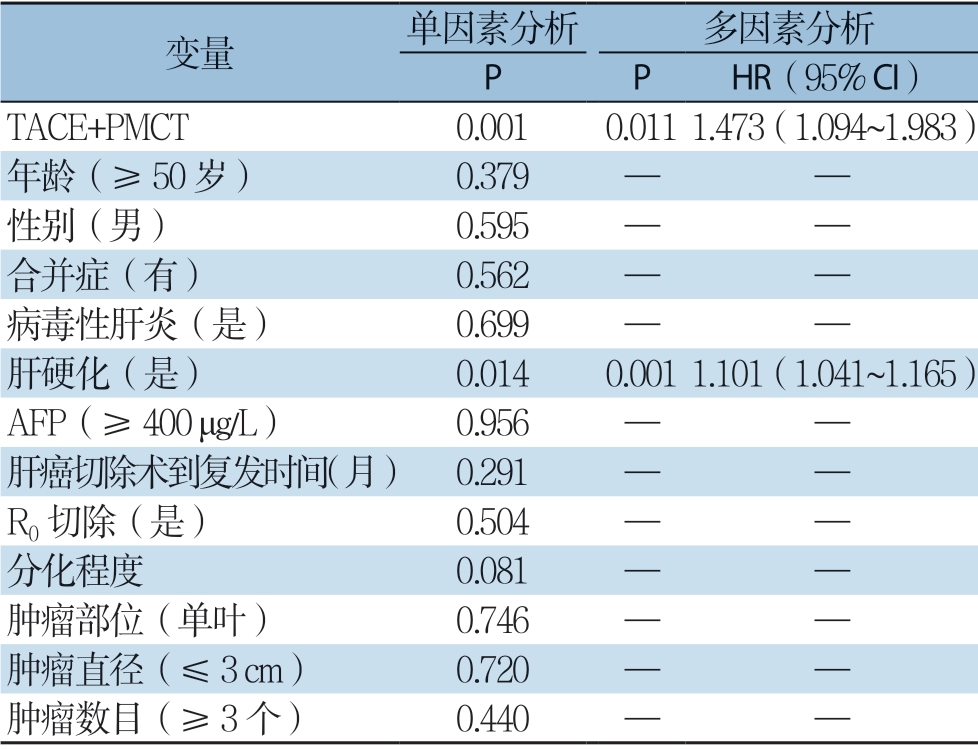
变量 单因素分析 多因素分析 P P HR(95% CI)TACE+PMCT 0.0010.0111.473(1.094~1.983)年龄(≥50 岁) 0.379 — —性别(男) 0.595 — —合并症(有) 0.562 — —病毒性肝炎(是) 0.699 — —肝硬化(是) 0.0140.0011.101(1.041~1.165) AFP(≥400 μg/L) 0.956 — —肝癌切除术到复发时间(月) 0.291 — —R0 切除(是) 0.504 — —分化程度 0.081 — —肿瘤部位(单叶) 0.746 — —肿瘤直径(≤3 cm) 0.720 — —肿瘤数目(≥3 个) 0.440 — —
表5 复发性HCC 患者RFS 单因素与多因素分析
Table5 Univariate and multivariate analysis of RFS in patients with recurrent HCC
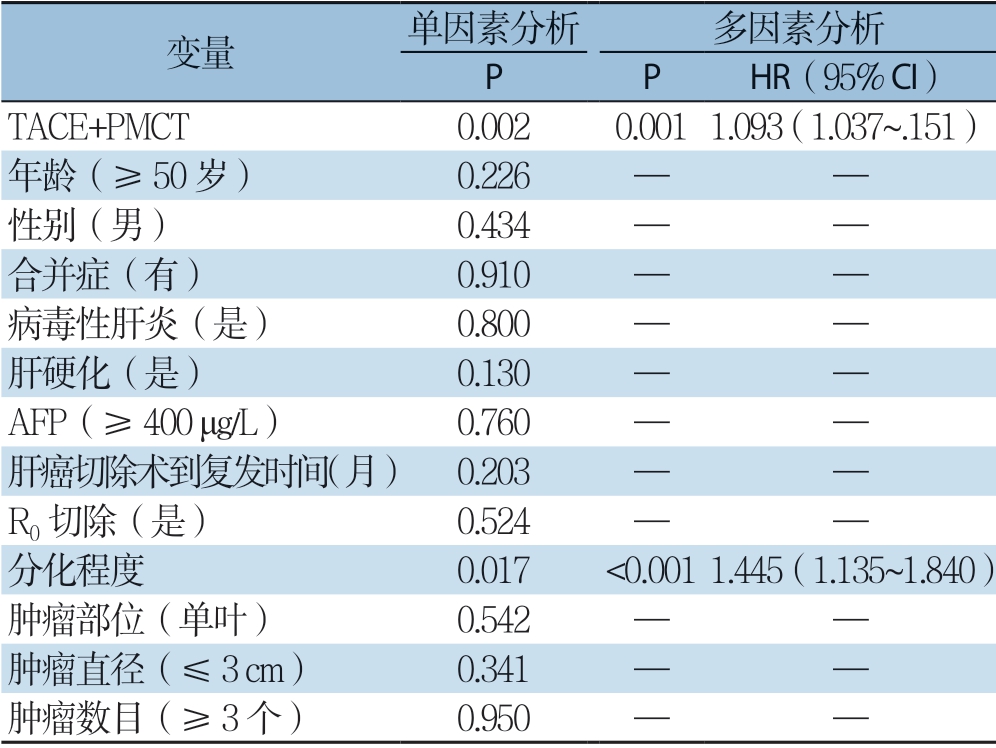
变量 单因素分析 多因素分析 P P HR(95% CI)TACE+PMCT 0.0020.0011.093(1.037~.151)年龄(≥50 岁) 0.226 — —性别(男) 0.434 — —合并症(有) 0.910 — —病毒性肝炎(是) 0.800 — —肝硬化(是) 0.130 — —AFP(≥400 μg/L) 0.760 — —肝癌切除术到复发时间(月) 0.203 — —R0 切除(是) 0.524 — —分化程度 0.017 <0.0011.445(1.135~1.840)肿瘤部位(单叶) 0.542 — —肿瘤直径(≤3 cm) 0.341 — —肿瘤数目(≥3 个) 0.950 — —
3 讨 论
HCC 手术切除后复发是影响患者远期生存率的关键因素[5,13]。对于复发性HCC的最佳治疗方案,目前尚无共识,世界各地的治疗策略也不尽相同。相关文献报道,复发性HCC 手术切除后,1、2、5年生存率分别在63.3%~95.0%、23.3%~55.9%、13.3%~46.0%[14],其远期疗效较高。但由于再次手术时腹腔粘连加重、肿瘤自身、发病特点及患者家属主观上难以接受等因素影响,手术的实施可能性极低,且手术难度较大,术后易出现严重并发症,很难实现满意的预后质量[15]。
TACE和TACE联合PMCT等多种治疗方法已广泛应用于原发性肝内肿瘤[10-12]。然而,TACE和TACE联合PMCT在复发性HCC治疗的研究比较尚未见报道。本研究发现TACE联合PMCT在治疗肝切除术后肝内复发性HCC的疾病进展控制方面优于TACE。这些结果反映了两种治疗模式在治疗机制上的差异。
PMCT治疗HCC的机制是基于微波的加热效应和肿瘤对加热作用的敏感性。电极插入肿瘤组织所产生的高温使肿瘤组织迅速凝固坏死,从而达到破坏肿瘤的目的。PMCT的治疗面积与微波电极的直径和数量、机器的输出功率、凝固时间和局部血液循环有关[10,16-19],随着电极直径、输出功率和凝固时间的增加,PMCT的治疗范围可以扩大。然而,增加电极直径也可能增加穿刺后出血的发生率,延长凝血时间可能导致患者疼痛更加剧烈。在实际应用中,微波治疗仪的电极直径和输出功率是恒定的。因此,减少局部血供是实现增加PMCT治疗面积的唯一途径。HCC血供比正常肝组织异常丰富。TACE治疗,特别是碘化油和明胶海绵颗粒的注射,阻断了动脉对肿瘤的血液供应。碘化油通过动脉与门静脉分支连接,充满肿瘤周围的门静脉[20-21]。因此,PMCT联合TACE治疗时,TACE可以减少门静脉的血流量从而达到PMCT对肿瘤持续恒温的作用[22-23]。此外,TACE可导致肿瘤组织缺血、炎性水肿,加速肿瘤坏死,增强微波的凝固作用[24]。这为TACE联合PMCT治疗肝癌肿瘤奠定了理论基础。
两组预后比较,TACE 联合PMCT 组总中位OS时间较TACE组长(43.1个月vs.19.0个月)。TACE+PMCT组中位RFS时间较TACE组长(36.0个月 vs.16.7个月)。与TACE 比较,TACE+PMCT可延迟HCC的复发时间,延长患者生存时间。单纯TACE治疗患者中位生存时间较短的原因可能与栓塞剂在治疗1~2年后发生碘油缺失有关,也可能是由于患者多次栓塞后出现动静脉瘘,影响TACE远期治疗效果[25]。
Orimo等[26]研究发现,肿瘤分期、肿瘤大小、分化程度和门静脉侵犯是HCC复发的独立预后因素。An等[27]研究发现血清AFP、肿瘤大小、肿瘤坏死、出血是肝切除术后肝内复发的危险因素。Schlitt等[28]研究发现Child-pugh评分作为肝内复发的独立危险因素并提示肝硬化是肝内复发的一个危险因素。研究证据表明原发性肿瘤负担(如肿瘤大小和AFP)和肝硬化程度(如Child-pugh评分)是HCC肝内复发的重要因素[29-32]。Hu等[33]的研究发现、大血管浸润、肿瘤最大直径和肿瘤复发时间间隔是肝切除术后整体生存的独立预测因子,并认为HCC复发的时间间隔肝切除术后肝移植后生存的一个重要因素。在本研究的多变量分析中,肝硬化,分化程度是HCC复发的独立预后因素。
本研究存在一定的局限性。首先,回顾性研究往往会产生潜在的偏倚。比如是否系统收集患者信息资料,在本次回顾性研究当中,笔者机构有专职人员对数据系统的收集与录入,保证实验数据的精确无误。然而,两组组间基线特征存在一些差异,包括从HCC切除到复发的时间、肿瘤直径和病因,但使用PSM来进一步消除组间基线特征的差异。第二,这项研究是基于单一机构的审查,可能不代表其他中心的发现。第三个局限性是时间跨度大(2007—2019年),在大跨度时间内,随着医疗技术和科技水平的飞速发展,关于疾病的诊治方案及后续继续治疗方面有所差异。尽管存在这些局限性,本研究结果仍具有临床意义,可以作为分析TACE 联合PMCT 治疗复发性HCC的长期疗效的重要参考。
综上所述,TACE联合PMCT治疗复发性HCC的预后优于单纯TACE,可提高肿瘤治疗的疗效,提高患者的OS和RFS,延长患者的生命。
[1] 李玉苓.维生素D及其受体与乙型肝炎病毒相关性肝细胞肝癌的关系[D].石家庄:河北医科大学,2015.
LI YL.Relationship between vitamin D and its receptor and hepatitis B virus related hepatocellular carcinoma[D].Shijiazhuang:Hebei Medical University,2015.
[2] Xie H,Wang H,An W,et al.The efficacy of radiofrequency ablation combined with transcatheter arterial chemoembolization for primary hepatocellular carcinoma in a cohort of 487 patients[J].PLoS One,2014,9(2):e89081.doi:10.1371/journal.pone.0089081.
[3] Takayama T,Makuuchi M,Hirohashi S,et al.Early hepatocellular carcinoma as an entity with a high rate of surgical cure[J].Hepatology,1998,28(5):1241–1246.doi:10.1002/hep.510280511.
[4] 钟林,彭志海,陈国庆,等.肝癌切除早期复发应纳入拯救性肝移植的选择标准[C]//2013中国器官移植大会论文汇编.杭州:2013中国器官移植大会委员会,2013年.
Zhong L,Peng ZH,Chen GQ,et al.Selection criteria of inclusion of salvage liver transplantation for early recurrence of liver cancer after hepatectomy[C]//Proceedings of 2013 organ transplantation conference.Hangzhou:Committee of 2013 organ transplantation conference,2013.
[5] Minagawa M,Makuuchi M,Takayama T,et al.Selection criteria for repeat hepatectomy in patients with recurrent hepatocellular carcinoma[J].Ann Surg,2003,238(5):703–710.doi:10.1097/01.sla.0000094549.11754.e6.
[6] 刘城林,梁昆,于礼建.复发性肝癌治疗的研究进展与展望[J].世界最新医学信息文摘,2018,18(84):23–27.doi:10.19613/j.cnki.1671–3141.2018.84.012.
Liu CL,Liang K,Yu JL.Research progress and prospect of treatment of recurrent liver cancer[J].World Latest Medicine(Electronic Version),2018,18(84):23–27.doi:10.19613/j.cnki.1671–3141.2018.84.012.
[7] Shi J,Sun Q,Wang Y,et al.Comparison of microwave ablation and surgical resection for treatment of hepatocellular carcinomas conforming to Milan criteria[J].J Gastroenterol Hepatol,2014,29(7):1500–1507.doi:10.1111/jgh.12572.
[8] Zhang EL,Yang F,Wu ZB,et al.Therapeutic efficacy of percutaneous microwave coagulation versus liver resection for single hepatocellular carcinoma ≤3 cm with Child-Pugh A cirrhosis[J].Eur J Surg Oncol,2016,42(5):690–697.doi:10.1016/j.ejso.2016.02.251.
[9] 董宝玮,梁萍,于晓玲,等.超声引导经皮微波消融治疗早期原发性肝癌的远期疗效[J].中华医学杂志,2006,86(12):797–800.doi:10.3760/j:issn:0376–2491.2006.12.002.
Dong BW,Liang P,Yu XL,et al.Long-term results of percutaneous sonographically-guided microwave ablation therapy of early-stage hepatocellular carcinoma [J].National Medical Journal of China,2006,86(12):797–800.doi:10.3760/j:issn:0376–2491.2006.12.002.
[10] Seki T,Tamai T,Nakagawa T,et al.Combination therapy with transcatheter arterial chemoembolization and percutaneous microwave coagulation therapy for hepatocellular carcinoma[J].Cancer,2000,89(6):1245–1251.
[11] Xu LF,Sun HL,Chen YT,et al.Large primary hepatocellular carcinoma:transarterial chemoembolization monotherapy versus combined transarterial chemoembolization-percutaneous microwave coagulation therapy[J].J Gastroenterol Hepatol,2013,28(3):456–463.doi:10.1111/jgh.12088.
[12] Wei YY,Dai F,Zhao T,et al.Transcatheter arterial chemoembolization monotherapy vs combined transcatheter arterial chemoembolization-percutaneous microwave coagulation therapy for massive hepatocellular carcinoma (≥10 cm)[J].Cancer Manag Res,2018,10:5273–5282.doi:10.2147/CMAR.S172395.
[13] Poon RT,Fan ST,Lo CM,et al.Improving survival results after resection of hepatocellular carcinoma:a prospective study of 377 patients over 10 years[J].Ann Surg,2001,234(1):63–70.doi:10.1097/00000658–200107000–00010.
[14] Huang ZM,Li W,Li S,et al.Cytokine-induced killer cells in combination with transcatheter arterial chemoembolization and radiofrequency ablation for hepatocellular carcinoma patients[J].J Immunother,2013,36(5):287–293.doi:10.1097/CJI.0b013e3182948452.
[15] Peng ZW,Chen MS.Transcatheter arterial chemoembolization combined with radiofrequency ablation for the treatment of hepatocellular carcinoma[J].Oncology,2013,84(Suppl 1):40–43.
[16] Dong BW,Liang P,Yu XL,et al.Sonographically guided microwave coagulation treatment of liver cancer:an experimental and clinical study[J].AJR Am J Roentgenol,1998,171(2):449–454.doi:10.2214/ajr.171.2.9694473.
[17] Yu NC,Raman SS,Kim YJ,et al.Microwave liver ablation:influence of hepatic vein size on heat-sink effect in a porcine model [J].J Vasc Interv Radiol,2008,19(7):1087–1092.doi:10.1016/j.jvir.2008.03.023.
[18] Hines-Peralta AU,Pirani N,Clegg P,et al.Microwave ablation:results with a 2.45-GHz applicator in ex vivo bovine and in vivo porcine liver [J].Radiology,2006,239(1):94–102.doi:10.1148/radiol.2383050262.
[19] Simon CJ,Dupuy DE,Iannitti DA,et al.Intraoperative triple antenna hepatic microwave ablation[J].AJR Am J Roentgenol,2006,187(4):W333–340.doi:10.2214/AJR.05.0804.
[20] Kan Z,Sato M,Ivancev K,et al.Distribution and effect of iodized poppyseed oil in the liver after hepatic artery embolization:experimental study in several animal species[J].Radiology,1993,186(3):861–866.doi:10.1148/radiology.186.3.8381552.
[21] Roche A.Transcatheter Arterial Chemoembolization of Hepatocellular Carcinoma[J].Hepatogastroenterology,1998,45(4):1236–1241.
[22] Patterson EJ,Scudamore CH,Owen DA,et al.Radiofrequency ablation of porcine liver in vivo:effects of blood flow and treatment time on lesion size[J].Ann Surg,1998,227(4):559–565.doi:10.1097/00000658–199804000–00018.
[23] Goldberg SN,Hahn PF,Tanabe KK,et al.Percutaneous radiofrequency tissue ablation:does perfusion-mediated tissue cooling limit coagulation necrosis?[J].J Vasc Interv Radiol,1998,9(1 Pt 1):101–111.doi:10.1016/s1051–0443(98)70491–9.
[24] 何文,梁晓宁,张晓蓉,等.超声引导微波联合肝动脉化疗栓塞术治疗大肝癌的疗效评价[J].中国微创外科杂志,2005,5(1):31–33.doi:10.3969/j.issn.1009–6604.2005.01.013.
He W,Liang XN,Zhang XR,et al.Evaluation of ultrasoundguided microwave coagulation in combination with transarterial chemoembolization for large hepatic cancers[J].Chinese Journal of Minimally Invasive Surgery,2005,5(1):31–33.doi:10.3969/j.issn.1009–6604.2005.01.013.
[25] 刘建中,胡广军,时玲玲,等.肝癌细胞迁移过程中Notch信号通路的作用效果[J].中国现代普通外科进展,2017,20(7):515–517.doi:10.3969/j.issn.1009–9905.2017.07.004.
Liu JZ,Hu GJ,Shi LL,et al.Effect of Notch signaling pathway in hepatocellular carcinoma cell migration[J].Chinese Journal of Current Advances in General Surgery,2017,20(7):515–517.doi:10.3969/j.issn.1009–9905.2017.07.004.
[26] Orimo T,Kamiyama T,Yokoo H,et al.Salvage Hepatectomy for Recurrent Hepatocellular Carcinoma after Radiofrequency Ablation and/or Transcatheter Arterial Chemoembolization:A Propensity Score-Matched Analysis[J].Dig Surg,2018,35(5):427–434.doi:10.1159/000480521.
[27] An HJ,Shin WY,Lee K ,et al.A comparison of the risk factors of intrahepatic recurrence,early recurrencen,and multiple recurrences after resection for single nodular hepatocellular carcinoma[J].Korean J Hepatobiliary Pancreat Surg,2015,19(3):89–97.doi:10.14701/kjhbps.2015.19.3.89.
[28] Schlitt HJ,Neipp M,Weimann A,et al.Recurrence patterns of hepatocellular and fibrolamellar carcinoma after liver transplantation[J].J Clin Oncol,1999,17(1):324–331.doi:10.1200/JCO.1999.17.1.324.
[29] Yoon MH,Choi YI,Park KK,et al.Risk Factors for Intrahepatic Recurrence after Resection of Hepatocellular Carcinomas in Patients with Hepatitis B Virus Infection [J].Korean J Hepatobiliary Pancreat Surg,2011,15(2):83–89.doi:10.14701/kjhbps.2011.15.2.83.
[30] Ng KK,Poon RT,Lo CM,et al.Analysis of recurrence pattern and its influence on survival outcome after radiofrequency ablation of hepatocellular carcinoma[J].J Gastrointest Surg,2008,12(1):183–191.doi:10.1007/s11605–007–0276-y.
[31] Pompili M,Rapaccini GL,de Luca F,et al.Risk factors for intrahepatic recurrence of hepatocellular carcinoma in cirrhotic patients treated by percutaneous ethanol injection[J].Cancer,1997,79(8):1501–1508.doi:10.1002/(sici)1097–0142(19970415)79:8<1501::aid-cncr9>3.0.co;2-d.
[32] An SL,Xiao T,Wang LM,et al.Prognostic Significance of Preoperative Serum Alpha- fetoprotein in Hepatocellular Carcinoma and Correlation with Clinicopathological Factors:a Singlecenter Experience from China[J].Asian Pac J Cancer Prev,2015,16(10):4421–4427.doi:10.7314/apjcp.2015.16.10.4421.
[33] Hu Z,Zhou J,Li Z,et al.Time interval to recurrence as a predictor of overall survival in salvage liver transplantation for patients with hepatocellular carcinoma associated with hepatitis B virus[J].Surgery,2015,157(2):239–248.doi:10.1016/j.surg.2014.09.018.
