目前,肝移植已成为治疗各种终末期肝病唯一有效的方法[1-2]。1963年美国匹兹堡大学Starzl教授实行了世界上首例原位肝移植,半个世纪以来,随着外科技术和围手术期管理的不断完善,患者的存活率得到了显著提高,目前手术的成功率已高达90%,术后5年生存率也接近80%[2]。然而,肝移植术后的一些并发症却困扰着广大的临床医生,移植术后新发糖尿病(new onset diabetes mellitus after transplantation,NODAT)便是常见的并发症之一。诸多研究表明,NODAT不仅会增加术后感染的几率,影响手术切口愈合,且与术后器官衰竭和心脑血管事件的发生密切相关,严重影响患者的预后及其生活质量[3-4]。本文主要从诊断标准、流行病学、发生机制及危险因素等方面对近年来NODAT的研究进展进行综述。
1 定义和诊断标准
NODAT是指术前无糖尿病的患者于移植术后出现持续性的高血糖现象。目前对于NODAT的诊断尚未统一,且因手术应激、麻醉、术后免疫抑制剂的使用、补液及其他因素等都会对患者血糖造成一定的影响,因此NODAT的诊断与一般人群有所不同。临床上常用的是2003年巴塞罗那国际专家推荐沿用美国糖尿病协会(American Diabetes Association,ADA)和世界卫生组织(World Health Organization,WHO)的诊断标准[5]:出现糖尿病症状,且随机血糖(random plasma glucose,RPG)≥11.1 mmol/L;或空腹血糖(fasting plasma glucose,FPG)≥7.0 mmol/L;或口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)2 h血糖值(2 h PG)≥11.1 mmol/L,以上数值需再测一次予以证实,诊断方可成立。因患者早期处于应激状态,血糖波动较大,正式诊断需待患者病情稳定后,即服用维持剂量的免疫抑制剂、移植物功能稳定且无各种急慢性的并发症等。术后早期糖化血红蛋白可发生很大的变异,因此不推荐糖化血红蛋白用于NODAT的一线诊断标准[6-7]。国外学者Hur等[8]根据以上诊断标准将NODAT细分为早期NODAT(移植术后1年内出现糖尿病),1年内无NODAT(移植术后1年内未出现糖尿病)。其中早期NODAT又可分为暂时性的NODAT(移植术后1年内出现糖尿病,但最终血糖正常)和持续性的NODAT(移植术后1年内出现糖尿病且糖尿病持续存在);1年内无NODAT又可分为晚期NODAT(移植术后1年后出现糖尿病)及移植术后一直未发生糖尿病。因持续性NODAT危害性大、是临床工作者关注的重点。
2 流行病学
随着肝移植外科手术技术及围手术期的管理不断成熟,手术的成功率及术后生存率得到了显著提高,但移植术后并发症等问题却日益凸显,NODAT便是主要的并发症之一。多数研究表明术后1年内是NODAT发生的高峰时期,尤以术后前3个月内最高,此后的发病率逐渐下降[9-10]。这可能与应激因素逐渐消失,免疫抑制剂调整及适应,移植物功能不断恢复、糖皮质激素减量或停用等有关。最近国内外研究报道术后1年内NODAT的发病率在8.4%~30%不等,可能与各研究中心样本量、供肝情况、随访时间及治疗方案的不同有关[11-13]。
与普通人群相比,NODAT的发生有其自身特点,具有一定的逆转性,研究表明受者的年龄、移植术后NODAT发生的时间、免疫抑制剂使用的剂量及时间都与NODAT的逆转性相关。但只有受者年龄才是NODAT发生逆转的独立因素,即受者年龄越小,其发生逆转可能性越大[14-15]。
3 危险因素
造成NODAT的危险因素有许多,根据危险因素是否可以在术前进行调控,分为不可调控性危险因素和可调控性危险因素(图1)。
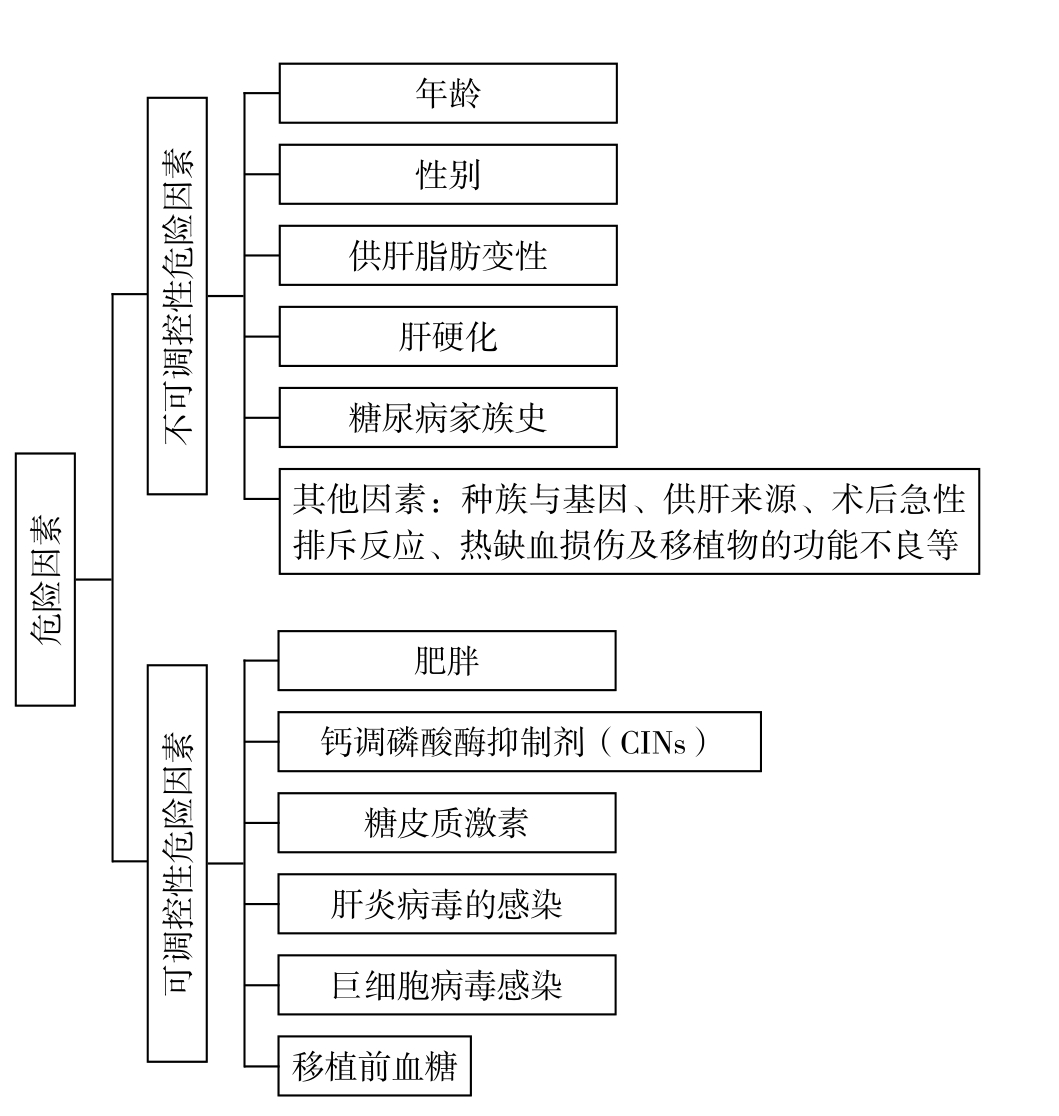
图1 NODAT的危险因素
Figure1 The risk factors of NODAT
3.1 不可调控性危险因素
3.1.1 年龄 随着年龄的增加,器官功能不断减退,对手术应激耐受性变差,术后易出现糖代谢紊乱。目前,许多学者都认为受者年龄是NODAT发生的危险因素。Ling等[4]总结发现受者年龄>50岁发生NODTA的风险是≤50岁的1.24倍,且年龄越大发生的风险越高。日本学者Yagi等[16]研究也表明受者年龄≥40岁发生NODAT的风险是<40岁 患 者 的 5.153倍(95% CI=1.387~33.64,P=0.0115)。高龄患者出现NODAT的原因可能与胰腺β细胞老化,功能降低及胰岛素抵抗有关。
3.1.2 性别 多数学者[4,13]认为性别与NODAT的发生没有相关性。但也有部分研究表明NODAT的发生具有性别倾向性。Liu等[12]通过单因素分析表明男性患者较女性患者NODAT的发生率可能更高(68.33% vs.31.67%,P<0.0372)。Li等 [17]利 用美国器官移植数据库对249 56例肝移植的受者进行多因素分析后表明男性NODAT发生率较女性要高(HR=1.17,95% CI=1.05~1.30,P=0.006),表明女性可能是NODAT的保护因素。Andrade等[18]研究也表明男性患者NODAT的发生率较女性要高。
3.1.3 供肝脂肪变性 肝脂肪变性可加重肝脏的负担,引起肝功能损伤,导致NODAT发生率升高。其发生机制可能是:一方面因肝功能损伤,胰岛素利用和灭活的减少,同时长期高胰岛素血症可造成外周组织胰岛素受体数量的减少,外周组织对胰岛素产生抵抗,机体对胰岛素敏感性降低;另一方面肝细胞损伤后引起肝脏葡萄糖激酶和糖原合酶活性降低,影响葡萄糖的磷酸化和糖原合成,促使血糖升高。最近Mitsuhashi等[19]通过一项大型人群队列研究发现一般人群肝脂肪变性后发生2型糖尿病的风险增大(HR=2.35,95% CI=1.91~2.89,P<0.001)。因此我们有理由相信在肝移植受者中供肝脂肪变性也可导致NODAT风险升高。Xue等[20]通过对2001—2014年在上海中山医院接受肝移植的受者进行回顾性分析发现,供肝脂肪变性较无脂肪变性的患者发生糖尿病的风险明 显 增 加(HR=1.774,95% CI=1.025~3.073,P=0.041),且患者的远期生存率也明显降低。
3.1.4 肝硬化 我国患者行肝移植的主要原发病因是各种慢性肝病,而慢性肝病的最终结局是肝硬化。有研究表明肝硬化程度越高,术后发生糖尿病的风险可能越大,特别是对于失代偿期的肝硬化患者[21-22]。其发生机制可能与胰岛素利用和灭活的减少有关,同时肝硬化患者因肝功能严重损害造成其血浆内有较高水平的胰高血糖素、生长激素、糖皮质激素及儿茶酚胺等胰岛素拮抗性激素,这将进一步加重胰岛素抵抗,造成术后高血糖水平。同时肝硬化的一些并发症如上消化道出血、肝性脑病、腹水等也会增加NODAT发生风险[12]。
3.1.5 糖尿病家族史 糖尿病的家族史被定义为患者的一级亲属或二级亲属中至少有1名被诊断为糖尿病。目前,学术界普遍认为糖尿病家族史是发生糖尿病的危险因素。2013年国外的1份病例对照研究表明,与无糖尿病家族史相比,父母均为糖尿病的患者,其子女今后发生糖尿病的风险升高(HR=5.14,95% CI=3.74~7.07),同时父母被诊断为糖尿病的年龄<50岁时,发生糖尿病的风险显著升高(HR=4.69,95% CI=3.35~6.58),此外,该研究还进一步表明当母亲为糖尿病患者时,子女今后发生糖尿病的风险可能会更高[23]。韩国的一项回顾性的研究[13]发现在肾移植受者中有糖尿病家族史的患者发生NODAT的风险明显增大(OR=2.48,95% CI=1.0~5.96)。Alshamsi等 [24]研究也发现糖尿病家族史是移植术后发生2型糖尿病的高危因素(P=0.001,RR=31.1)。
3.1.6 其他因素 影响肝移植术后发生NODAT的危险因素还包括种族与基因、供肝的来源、术后急性排斥反应、热缺血损伤及移植物的功能不良 等[10,12,16,21,25]。
3.2 可调控性危险因素
3.2.1 肥胖 肥胖是一般人群发生2型糖尿病公认的危险因素,也是肝移植术后发生糖尿病的高危因素。目前,国际上将体质量指数(BMI)≥25 kg/m2定义为肥胖。Ling等[4]通过对中国肝移植数据库的研究表明: 当 BMI≥ 25 kg/m2 时 NODAT 的发病率较BMI<25 kg/m2高 1.25 倍(95% CI=1.120~1.369,P<0.001)。国外的一项回顾性研究[13]也表明肥胖患者术后发生NODAT的明显风险升高(OR=3.46,95% CI=1.55~7.73,P=0.002)。但因人群种族的差异,许多亚洲人出现糖尿病时可能有着正常甚至较低的BMI值,故有学者[26-27]提出腹围可能比BMI更适合作为衡量肥胖的标准,研究表明腹围与内脏肥胖、胰岛素抵抗及血脂异常有较好的相关性,而这些都与2型糖尿病的发生密切相关。因此肥胖患者在术前尽可能降低体重及腹围对于减少NODAT发生是有必要的。
3.2.2 钙调磷酸酶抑制剂(calcineurin inhibitors,CNIs) CNIs包括环孢霉素(cyclosporine A,CsA)和他克莫司(tacrolimus,TAC)。作为一类高效的免疫抑制药物,在过去的40年间被广泛的运用于器官移植中,极大的促进了器官移植的发展,却导致移植术后发生糖代谢紊乱及糖尿病[28]。其发生机制可能是:钙调磷酸酶作为一种Ca2+依赖性磷酸酶,CsA及TAC与相应的受体蛋白结合后可抑制钙调磷酸酶的活性。因免疫排斥反应多由T淋巴细胞介导,T细胞的活化需要Ca2+参与;CNIs通过阻断Ca2+介导的信号通路,抑制T淋巴细胞的活化,发挥抗免疫排斥作用。因胰腺β细胞分泌胰岛素也需Ca2+介导的信号通路参与,因此CNIs可影响胰岛素的合成及分泌,造成术后糖代谢紊乱[29]。2017年西班牙学者Triñanes等[30]通过研究表明TAC对于胰腺β细胞有一定的毒性损伤作用,可使胰腺β细胞胞质出现肿胀、空泡化并诱导其凋亡,导致胰岛素合成及分泌量的降低、造成胰岛素抵抗,但这种损伤是可逆的,在停用后一定时间内可得到改善。Song等[31]通过收集1999年至2014年在华西医院肝移植中心行肝移植受者资料表明:肝移植术后出现糖尿病组较未出现糖尿病组TAC血药浓度明显升高[(7.66±3.4 1)n g/m L v s.(4.4 7±2.2 2)n g/m L,P<0.05)],糖尿病组术后1、5、10年的整体生存率及移植物存活率整体均较对照组低,此外该研究建议维持低剂量的TAC浓度(<5.89 ng/mL)对肝移植受者是安全有效的,且能降低NODAT的发生率。Muduman和Liu等[32-33]通过总结前人经验表明TAC较CsA可降低移植术后的病死率、急性排斥反应及高血压等不良反应,却导致NODAT发生率上升。因此TAC作为移植术后常用的免疫抑制剂,需严密监测患者的血糖、血药浓度及肾功能等情况。目前临床上已有一些新的免疫抑制剂,如西罗莫司、依维莫司等,这些药物致糖代谢紊乱的风险较CNIs低,但因其免疫抑制作用较CNIs弱,一般用于移植术后稳定期的维持治疗或NODAT的高危患者[34]。
另一方面CNIs可引起血清Mg2+水平降低,造成低镁血症[35]。低镁血症也是NODAT的危险因素,其发生机制可能是:低镁血症可降低胰岛素酪氨酸激酶的活性,影响胰岛素的合成和分泌,造成移植术后高血糖现象,这表明CNIs升高血糖的作用在一定程度上是通过诱导低镁血症而产生。Van Laecke等[36]研究发现:肝移植受者中出现糖尿病的患者其术前及术后第1个月内血清Mg2+浓度均较低,证实了低镁血症为NODAT的危险因素。2016年Sinangil等[37]进一步发现术前血清Mg2+浓度越低,NODAT的发生率可能性越大(Mg2+<2.1 mg/dL,P<0.001)。因此在术前及时补充镁剂,术后密切监测血清镁水平有助于减少NODAT的发生。
3.2.3 糖皮质激素 目前糖皮质激素仍是肝移植围手术期不可缺少的基础免疫抑制剂之一,常在术中和术后短时间内大剂量使用,却可引起移植术后糖代谢紊乱。其可能机制是:一方面糖皮质激素可抑制外周组织对葡萄糖的摄取和利用,增加肝脏糖异生;另一方面因其对胰腺β细胞有毒性作用及抗增殖作用,影响胰岛素的合成和分泌、造成NODAT的发生,且NODAT的发生率与使用时间和剂量呈正相关性[38-39]。Castedal等[40]在一项针对238例肝移植受者的回顾性分析中发现:在接受免疫抑制剂维持治疗条件下,接受糖皮质激素治疗和无激素治疗的受者NODAT发生率分别是16.8%和2.9%(P<0.01)。Kim等[41]研究也表明,与传统免疫疗法相比较(术后接受TAC及糖皮质激素联合治疗的抗排斥方案,糖皮质激素在术后2~6个月内逐渐减量撤离),早期的激素撤离方案(联合TAC和霉酚酸酯的抗排斥方案,糖皮质激素在术后7 d内逐渐减量撤离),前者的NODAT发生率明显升高(11.6% vs.5.7%,HR=5.128,95% CI=0.93~28.40,P<0.05),提示早期停用糖皮质激素可能会减少NODAT的发生率。但上述研究大多为单中心、回顾性的研究,样本量有限,且对术后激素早期撤离或无激素治疗的安全性和有效性还有待于进一步研究。但在不增加各种急慢性免疫排斥反应发生的基础上,选择个体化激素用量的免疫抑制方案可减少NODAT的发生。
3.2.4 肝炎病毒的感染 许多学者已经证实HCV感染和NODAT的发生密切相关,但是HCV导致NODAT的具体机制尚不十分明确。其可能原因为:HCV病毒直接在胰岛β细胞内复制,造成胰腺β细胞功能障碍和自身免疫性的破坏,导致胰岛素合成和分泌不足;HCV直接损害肝细胞,造成肝细胞胰岛素利用障碍,产生胰岛素抵抗;HCV还可通过介导胰岛素信号通路,影响胰岛素相关蛋白合成,最终影响胰岛素合成及分泌。Hum等[42]发现对糖尿病合并HCV感染阳性者进行持续抗病毒治疗后,患者的血糖可得到一定的控制,同时也可减少胰岛素的使用。Li等[17]通过对249 56例肝移植受者进行回顾性研究表明,HCV感染阳性者较HCV感染阴性者发生NODAT的 风 险 升 高(HR=1.17,95% CI=1.09~1.27,P<0.001)。Ling等[4]研究也表明NODAT的患者中HCV感染阳性比例较高,且通过单因素分析表明HBV感染也是NODAT的危险因素(OR=1.151,95% CI=1.026~1.293,P=0.017)。因大多肝移植受者可合并HBV感染,且HBV也可导致肝细胞损伤,因此HBV感染可能与NODAT的发生有关,但有关HBV感染与NODAT的相关研究报道较少,还有待于进一步的研究。
3.2.5 巨细胞病毒感染 部分学者[4,36]研究发现巨细胞病毒(CMV)感染是引起NODAT的另一危险因素。且移植术后免疫抑制剂的长期使用造成CMV感染更为普遍,一定程度上增加了NODAT的发生率。其发生原因可能是CMV诱导或白细胞介导的促炎性细胞因子造成胰腺β细胞损伤,引起胰岛素分泌不足或胰岛素抵抗,但具体机制尚未明确。韩国学者Yoo等[43]通过研究发现CMV感染阳性组较CMV阴性组发生2型糖尿病风险明显增加(5.6% vs.2.2%,P<0.001),同时糖尿病组较非糖尿病组出现CMV感染相关性的疾病也明显增加(33.7% vs.16.2%,P<0.001),这提示两者可能发生相互影响,因缺乏相关大样本研究,其具体机制还有待于进一步的研究。但围手术期预防CMV的感染,有助于减少NODAT的发生及缩短患者的住院时间。
3.2.6 移植前血糖 2003年NODAT国际指南提出,移植术前空腹血糖调节受损和糖耐量异常均是NODAT的危险因素。建议对于血糖正常的患者术后第1个月内至少每周进行一次血糖检测、之后的1年内每3个月检测1次、1年后每半年进行1次,如果发现空腹血糖调节受损,应立即行OGTT[6]。研究表明移植术前空腹血糖调节受损是NODAT的先兆表现,具有一定的预测性,术前空腹血糖越高,发生NODAT的风险越大[44-45]。因此术前应对血糖调节异常者采取积极有效的控制方案。
4 危害及防治
NODAT不仅会增加术后感染和心脑血管事件的发生率,而且与移植物失功及器官衰竭密切相关,严重影响患者的预后及其生活质量。临床上应对高危人群采取积极的防治措施,通过术前充分的评估和准备、术后早期预防与治疗,以期降低NODAT的发生率,减少并发症的发生,最终提高患者的生存率及远期生活质量。
5 小 结
NODAT是肝移植术后常见的并发症,其发生与多种因素有关。其中不可调控性危险因素包括年龄、性别、供肝脂肪变性、肝硬化、糖尿病家族史,种族和基因、供肝的来源、术后急性排斥反应、热缺血损伤及移植物的功能不良等。可调控性危险因素包括肥胖、CNIs、糖皮质激素、肝炎病毒感染、巨细胞病毒感染及移植前血糖等因素。通过了解其发病机制及危险因素,对高危患者进行早期干预,制定个体化的治疗措施,降低NODAT的发生率,对于提高患者的远期生存率及生活质量具有重大的临床意义。
[1]Farkas S,Hackl C,Schlitt HJ.Overview of the indications and contraindications for liver transplantation[J].Cold Spring Harb Perspect Med,2014,4(5).pii:a015602.doi:10.1101/cshperspect.a015602.
[2]Samuel D,Coilly A.Management of patients with liver diseases on the waiting list for transplantation:a major impact to the success of liver transplantation[J].BMC Med,2018,16(1):113.doi:10.1186/s12916-018-1110-y.
[3]Roccaro GA,Goldberg DS,Hwang WT,et al.Sustained Posttransplantation Diabetes Is Associated With Long-Term Major Cardiovascular Events Following Liver Transplantation[J].Am J Transplant,2018,18(1):207-215.doi:10.1111/ajt.14401.
[4]Ling Q,Xu X,Xie H,et al.New-onset diabetes after liver transplantation:a national report from China Liver Transplant Registry[J].Liver Int,2016,36(5):705-712.doi:10.1111/liv.13042.
[5]American Diabetes Association.Diagnosis and classification of diabetes mellitus[J].Diabetes Care,2012,35(Suppl 1):S64-71.doi:10.2337/dc12-s064.
[6]Pimentel AL,Camargo JL.Variability of glycated hemoglobin levels in the first year post renal transplantation in patients without diabetes[J].Clin Biochem,2017,50(18):997-1001.doi:10.1016/j.clinbiochem.2017.07.009.
[7]Cooper L,Oz N,Fishman G,et al.New onset diabetes after kidney transplantation is associated with increased mortality-A retrospective cohort study[J].Diabetes Metab Res Rev,2017,33(8).doi:10.1002/dmrr.2920.
[8]Hur KY,Kim MS,Kim YS,et al.Risk factors associated with the onset and progression of posttransplantation diabetes in renal allograft recipients[J].Diabetes Care,2007,30(3):609-615.doi:10.2337/dc06-1277.
[9]Li DW,Lu TF,Hua XW,et al.Risk factors for new onset diabetes mellitus after liver transplantation:A meta-analysis[J].World J Gastroenterol,2015,21(20):6329-6340.doi:10.3748/wjg.v21.i20.6329.
[10]Hartog H,May CJ,Corbett C,et al.Early occurrence of new-onset diabetes after transplantation is related to type of liver graft and warm ischaemic injury[J].Liver Int,2015,35(6):1739-1747.doi:10.1111/liv.12706.
[11]Xue M,Lv C,Chen X,et al.Effect of interleukin-2 receptor antagonists on new-onset diabetes after liver transplantation:A retrospective cohort study[J].J Diabetes,2016,8(4):579-587.doi:10.1111/1753-0407.12356.
[12]Liu FC,Lin JR,Chen HP,et al.Prevalence,predictive factors,and survival outcome of new-onset diabetes after liver transplantation:A population-based cohort study[J].Medicine (Baltimore),2016,95(25):e3829.doi:10.1097/MD.0000000000003829.
[13]Yu H,Kim H,Baek CH,et al.Risk factors for new-onset diabetes mellitus after living donor kidney transplantation in Korea - a retrospective single center study[J].BMC Nephrol,2016,17(1):106.doi:10.1186/s12882-016-0321-8.
[14]Martínez-Díaz-Guerra G,Guadalix S,Aramendi M,et al.Serum Levels of Osteocalcin and Insulin Resistance in Patients with Impaired Glucose Tolerance or New-Onset Diabetes Mellitus After Liver Transplantation[J].Horm Metab Res,2016,48(5):325-330.doi:10.1055/s-0035-1569288.
[15]Regelmann MO,Goldis M,Arnon R.New-onset diabetes mellitus after pediatric liver transplantation[J].Pediatr Transplant,2015,19(5):452-459.doi:10.1111/petr.12523.
[16]Yagi S,Kaido T,Iida T,et al.New-onset diabetes mellitus after living-donor liver transplantation:association with graft synthetic function[J].Surg Today,2017,47(6):733-742.doi:10.1007/s00595-016-1444-z.
[17]Li Z,Sun F,Hu Z,et al.New-Onset Diabetes Mellitus in Liver Transplant Recipients With Hepatitis C:Analysis of the National Database[J].Transplant Proc,2016,48(1):138-144.doi:10.1016/j.transproceed.2015.11.010.
[18]Andrade AR,Bittencourt PL,Codes L,et al.New Onset Diabetes and Non-Alcoholic Fatty Liver Disease after Liver Transplantation[J].Ann Hepatol,2017,16(6):932-940.doi:10.5604/01.3001.0010.5285.
[19]Mitsuhashi K,Hashimoto Y,Hamaguchi M,et al.Impact of fatty liver disease and metabolic syndrome on incident type 2 diabetes;a population based cohort study[J].Endocr J,2017,64(11):1105-1114.doi:10.1507/endocrj.EJ17-0245.
[20]Xue M,Lv C,Chen X,et al.Donor liver steatosis:A risk factor for early new-onset diabetes after liver transplantation[J].J Diabetes Investig,2017,8(2):181-187.doi:10.1111/jdi.12560.
[21]Yadav AD,Chang YH,Aqel BA,et al.New Onset Diabetes Mellitus in Living Donor versus Deceased Donor Liver Transplant Recipients:Analysis of the UNOS/OPTN Database[J].J Transplant.2013,2013:269096.doi:10.1155/2013/269096.
[22]Thuluvath PJ,Hanish S,Savva Y.Liver Transplantation in Cryptogenic Cirrhosis:Outcome Comparisons Between NASH,Alcoholic,and AIH Cirrhosis[J].Transplantation,2018,102(4):656-663.doi:10.1097/TP.0000000000002030.
[23]InterAct Consortium,Scott RA,Langenberg C,et al.The link between family history and risk of type 2 diabetes is not explained by anthropometric,lifestyle or genetic risk factors:the EPICInterAct study[J].Diabetologia,2013,56(1):60-69.doi:10.1007/s00125-012-2715-x.
[24]Alshamsi S,Basri N,Flaiw A,et al.Predictability and Risk Factors for Development of New-Onset Type 2 Diabetes Mellitus After Transplant in the Saudi Population[J].Exp Clin Transplant,2016,14(3):271-275.
[25]Lim TR,Mutimer DJ.Editorial:The association of hepatitis C virus infection and post-liver transplant diabetes[J].Aliment Pharmacol Ther,2015,41(5):488.doi:10.1111/apt.13064.
[26]Seo DC,Choe S,Torabi MR.Is waist circumference ≥102/88cm better than body mass index ≥30 to predict hypertension and diabetes development regardless of gender,age group,and race/ethnicity? Meta-analysis[J].Prev Med,2017,97:100-108.doi:10.1016/j.ypmed.2017.01.012.
[27]Li S,Xiao J,Ji L,et al.BMI and waist circumference are associated with impaired glucose metabolism and type 2 diabetes in normal weight Chinese adults[J].J Diabetes Complications,2014,28(4):470-476.doi:10.1016/j.jdiacomp.2014.03.015.
[28]Chakkera HA,Kudva Y,Kaplan B.Calcineurin Inhibitors:Pharmacologic Mechanisms Impacting Both Insulin Resistance and Insulin Secretion Leading to Glucose Dysregulation and Diabetes Mellitus[J].Clin Pharmacol Ther,2017,101(1):114-120.doi:10.1002/cpt.546.
[29]Kalwat MA,Cobb MH.Mechanisms of the amplifying pathway of insulin secretion in the β cell[J].Pharmacol Ther,2017,179:17-30.doi:10.1016/j.pharmthera.2017.05.003.
[30]Triñanes J,Rodriguez-Rodriguez AE,Brito-Casillas Y,et al.Deciphering Tacrolimus-Induced Toxicity in Pancreatic β Cells[J].Am J Transplant,2017,17(11):2829-2840.doi:10.1111/ajt.14323.
[31]Song JL,Gao W,Zhong Y,et al.Minimizing tacrolimus decreases the risk of new-onset diabetes mellitus after liver transplantation[J].World J Gastroenterol,2016,22(6):2133-2141.doi:10.3748/wjg.v22.i6.2133.
[32]Muduma G,Saunders R,Odeyemi I,et al.Systematic Review and Meta-Analysis of Tacrolimus versus Ciclosporin as Primary Immunosuppression After Liver Transplant[J].PLoS One,2016,11(11):e0160421.doi:10.1371/journal.pone.0160421.
[33]Liu JY,You RX,Guo M,et al.Tacrolimus Versus Cyclosporine as Primary Immunosuppressant After Renal Transplantation:A Meta-Analysis and Economics Evaluation[J].Am J Ther,2016,23(3):e810-824.doi:10.1097/MJT.0000000000000150.
[34]Charlton M,Rinella M,Patel D,et al.Everolimus Is Associated With Less Weight Gain Than Tacrolimus 2 Years After Liver Transplantation:Results of a Randomized Multicenter Study[J].Transplantation,2017,101(12):2873-2882.doi:10.1097/TP.0000000000001913.
[35]Rodrigues N,Santana A,Guerra J,et al.Serum Magnesium and Related Factors in Long-Term Renal Transplant Recipients:An Observational Study[J].Transplant Proc,2017,49(4):799-802.doi:10.1016/j.transproceed.2017.01.070.
[36]Van Laecke S,Desideri F,Geerts A,et al.Hypomagnesemia and the risk of new-onset diabetes after liver transplantation[J].Liver Transpl,2010,16(11):1278-1287.doi:10.1002/lt.22146.
[37]Sinangil A,Celik V,Barlas S,et al.New-Onset Diabetes After Kidney Transplantation and Pretransplant Hypomagnesemia[J].Prog Transplant,2016,26(1):55-61.doi:10.1177/1526924816633949.
[38]Fine NHF,Doig CL,Elhassan YS,et al.Glucocorticoids Reprogram β-Cell Signaling to Preserve Insulin Secretion[J].Diabetes,2018,67(2):278-290.doi:10.2337/db16-1356.
[39]Fransson L,Rosengren V,Saha TK,et al.Mitogen-activated protein kinases and protein phosphatase 5 mediate glucocorticoid-induced cytotoxicity in pancreatic islets and β-cells[J].Mol Cell Endocrinol,2014,383(1/2):126-136.doi:10.1016/j.mce.2013.12.010.
[40]Castedal M,Skoglund C,Axelson C,et al.Steroid-free immunosuppression with low-dose tacrolimus is safe and significantly reduces the incidence of new-onset diabetes mellitus following liver transplantation[J].Scand J Gastroenterol,2018,53(6):741-747.doi:10.1080/00365521.2018.1463390.
[41]Kim YK,Lee KW,Kim SH,et al.Early steroid withdrawal regimen prevents new-onset diabetes mellitus in old-age recipients after living donor liver transplantation[J].World J Surg,2012,36(10):2443-2448.doi:10.1007/s00268-012-1661-6.
[42]Hum J,Jou JH,Green PK,et al.Improvement in Glycemic Control of Type 2 Diabetes After Successful Treatment of Hepatitis C Virus[J].Diabetes Care,2017,40(9):1173-1180.doi:10.2337/dc17-0485.
[43]Yoo SG,Han KD,Lee KH,et al.Impact of Cytomegalovirus Disease on New-Onset Type 2 Diabetes Mellitus:Population-Based Matched Case-Control Cohort Study[J].Diabetes Metab J,2019,doi:10.4093/dmj.2018.0167.[Epub ahead of print]
[44]Gomes V,Ferreira F,Guerra J,et al.New-onset diabetes after kidney transplantation:Incidence and associated factors[J].World J Diabetes,2018,9(7):132-137.doi:10.4239/wjd.v9.i7.132.
[45]Aleid H,Alhuraiji A,Alqaraawi A,et al.New-onset diabetes after kidney transplantation:Incidence,risk factors,and outcomes[J].Saudi J Kidney Dis Transpl,2016,27(6):1155-1161.
