肝细胞癌是常见的恶性肿瘤[1],常通过取肝脏活体组织进行病理诊断或者通过影像学诊断,影像征像表现为病变在动态增强CT或者增强磁共振成像(contrast-enhanced magnetic resonance imaging,CE-MRI)上显示肝动脉期显著强化,门脉期和延时期肿瘤强化明显减弱或降低,甲胎蛋白水平为≥200 ng/mL[2]。外科手术治疗是提高患者远期生存率最重要的手段[3],动脉灌注化疗栓塞治疗(transcatheter arterial chemoembolization,TACE),对于无法外科手术切除的原发性和一些继发性肝癌患者,是有效的治疗方法[4]。不管选用哪种治疗方法[5],肝胆外科,放射介入科或肿瘤科医师都会对肝脏肿瘤的体积大小进行测算,以评估疗效。目前,肝胆外科,放射介入科或肿瘤科医生对于肝脏肿瘤的大小评估,通常基于横断面测量其前后径和左右径,冠状面或矢状面测量肿瘤的上下径,这是一种简易和粗略的估计肿瘤大小的方法[6]。人工智能的广泛应用,使计算机工作站精确测量肿瘤体积成为可能[7],对肿瘤体积进行三维定量的分割技术,经过临床认证,确认在技术上可行,可重复性高[8]。把图像导入后处理工作站,在CT和MRI动态增强三维序列图像上利用区域生长和主动轮廓模型病变分割技术,手画感兴趣体积(volume of interest,VOI),能快速测量病变体积,具有操作方便,计算精确的优点,具有重要的临床应用价值。但患者进行影像诊断及随访时选择的检查方法不尽相同,有时选择增强CT,有时选择CE-MRI。这就给临床医生带来了一个困惑,对于同一患者两种不同影像学检查方法所测算的肿瘤体积是否具有一致性?这关系到临床医生能否精确的评估患者肿瘤体积变化情况,评估患者的治疗效果。本研究拟采用区域生长和主动轮廓模型(active contour model,ACM)病变分割技术,比较3D分割技术在同一肝细胞癌患者的增强CT与CE-MRI对肿瘤体积大小的评估是否具有一致性。
1 资料与方法
1.1 一般资料
本回顾性研究方案符合人体试验伦理学标准,并得到中南大学湘雅二医院医学伦理委员会批准,患者均免除签署知情同意书。研究回顾性纳入2014年11月—2018年12月中南大学湘雅二医院肝胆外科或者放射介入科收治住院的肝细胞癌患者75例,纳入标准:⑴ 首次入院诊断为肝细胞癌;⑵ 经过肝脏活检或者手术病理证实为肝细胞癌;⑶ 术前同时进行了增强CT和增强MRI检查;⑷ CT和MR检查屏气配合良好,图像无显著呼吸及其他运动伪影干扰。排除标准:⑴ 胆管细胞癌及其他病理类型被排除;⑵ 病变形态不典型,或病灶小而被排除;⑶ 屏气不好,运动伪影明显而造成图像质量差的病例排除。共收集60例病例统计分析,其中47例男性患者,13例女性患者;年龄范围在29~75岁之间,平均年龄(53.3±11.7)岁。追踪到42例患者接受了肿瘤肝叶切除术,18例患者接受了肝穿刺活检。病例诊断均为肝细胞癌。
1.2 设备与技术参数
所有患者均采用第三代双源CT(SOMATOM Definition Force,Siemens Healthcare,Forchheim,Germany)行腹部CT成像,患者仰卧位,头先进,呼气末屏气扫描。经肘前静脉注射已预热好的非离子型对比剂(碘佛醇,350 mgI/mL),按照1.5 mL/kg注射,注射流率为 2.5 mL/s。无预设值开启智能管电压调制技术(CARE Kv,Siemens Healthcare)联合智能管电流调制技术(CareDose 4D,Siemens Healthcare)。设备参数如下:双96排光子探测器,探测器准直宽度为2 mm×96 mm×0.6 mm,螺距为1.2,旋转时间为0.5 s/r。在肝动脉期(延时,25~30 s),门脉期(延时,80 s)和延时期(延时,300 s)分别进行扫描。自动重建层厚1.00 mm、重建增量0.7 mm,卷积核Br40的腹窗图像,启用迭代重建技术(ADMIRE,Siemens Healthcare,Forchheim,Germany),迭代强度选择机器默认的2。所有图像数据传输至后处理工作站(Syngo.Via VB10B,Siemens Healthcare,Forchheim,Germany),利用区域生长和主动轮廓模型病变分割技术,手画VOI体积测量。
所有患者均在西门子MAGNETOM Skyra 3.0T的磁共振机器上进行肝脏扫描,扫描采用联合西门子体部相控阵18通道线圈和32通道脊柱线圈,对比剂为钆喷酸葡胺(Gd-DTPA)注射液以0.1 mmol/kg静脉注射后行对比增强。使用Medrad高压注射器加20 mL生理盐水冲管。在动脉期(注药后20 s)和门脉期(注药后60 s)分别扫描,之后延时到300 s扫延时期。采用CE-MRI成像的动脉期和门脉期图像用于研究。成像序列及参数见表1。
表1 MRI系列参数
Table1 MRI quantitative parameters
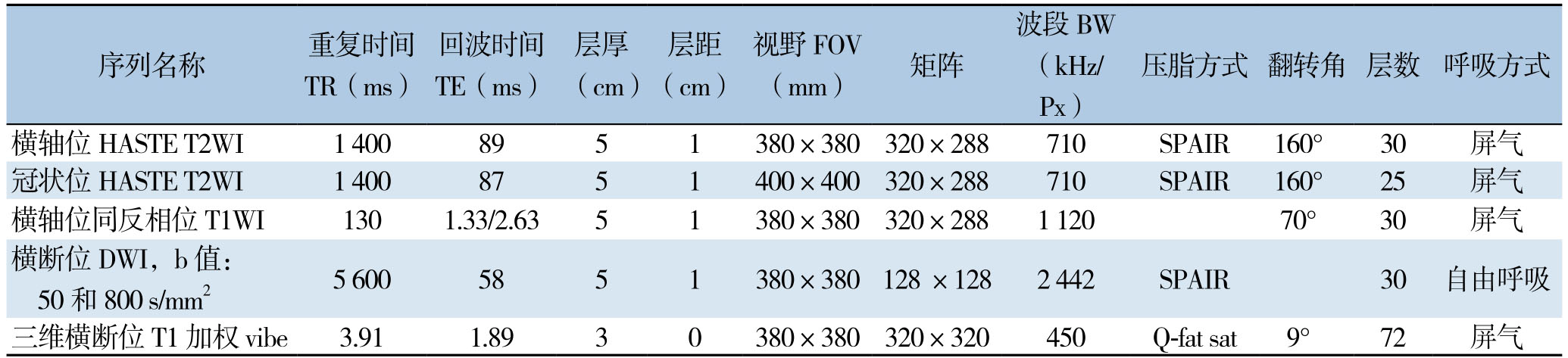
注:HASTE:半傅里叶采集单次激发;VIBE:容积内插屏气扫描序列;DWI:扩散加权成像
Note:HASTE:Half-fourier acquisition single-shot turbo spin-echo;VIBE:Volumetric interpolated breath-hold examination;DWI:Diffusion weighted imaging
images/BZ_107_213_1603_2266_1761.pngimages/BZ_107_213_1810_2266_2017.png横轴位HASTE T2WI 1 400 89 5 1 380×380320×288 710 SPAIR 160° 30 屏气三维横断位T1加权 vibe 3.91 1.89 3 0 380×380 320×320 450 Q-fat sat 9° 72 屏气
1.3 体积计算方法
本研究由两名具有10年以上腹部放射诊断经验的影像医生选择并评估靶病变然后进行切割。将动脉期和静脉期横断位薄层图像调入后处理工作站(Syngo.Via VB10B,Siemens,Germany),指定工作流程为MM阅片,打开手画VOI工具,在横断位图像上对肿瘤进行逐层手工分割,最后点击创建VOI,软件进行自动重组并计算出相应肿瘤的体积,具体步骤为:⑴ 横断位图像调入后处理工作站;⑵ 指定工作流程为MM阅片;⑶ 打开手画VOI工具;⑷ 横断位图像对肿瘤区域进行逐层手工分割;⑸ 利用轻推工具和校正笔微调;⑹ 创建VOI;⑺ 软件自动重组并得到肿瘤体积。
1.4 统计学处理
将数据导入计算机软件SPSS 23.0,肿瘤体积数据在CE-MRI和CT之间先行正态分布检验和方差齐性检验,再使用配对t检验比较,CE-MRI和CT增强肿瘤体积使用线性回归模型进行比较。计算Pearson相关系数。P<0.05为差异有统计学意义。
2 结 果
2.1 两种成像方法的一般特征
15例患者由于影像学表现不典型,肝动静脉瘘,或病变太小被排除。60例患者被纳入研究。研究组病例典型的MRI表现为:肝脏体积增大,可见团块状软组织影,肿块在T2WI上显示高信号,T1WI呈稍低信号,增强扫描病变动脉期中度不均匀强化,门脉期强化减退;腹膜后有时见肿大淋巴结;门脉主干及左右支部分病例有癌栓形成,门脉主干增粗,脾门静脉血管迂曲,扩张。CT表现为:平扫肝实质内可见不均质低密度肿块影,增强扫描动脉期呈显著不均匀性强化,门脉期强化程度减退,内见片状低密度无强化区。部分患者肝实质内可见散在子灶,肝周、脾周见少许水样密度影。腹膜后见肿大淋巴结影。
2.2 两种成像方法的一致性分析
肿瘤体积的平均值在C E-M R I上为(2 3.5 3±7.6 3)c m3;在增强C T上为(22.72±7.49)cm³(图1),两种成像方法测量的肿瘤体积结果比较无统计学意义(t=0.59,P=0.56)。两种种成像方法测量的病灶体积之间具有强相关性(r=0.99,95% CI=0.97~0.99)(图2)。
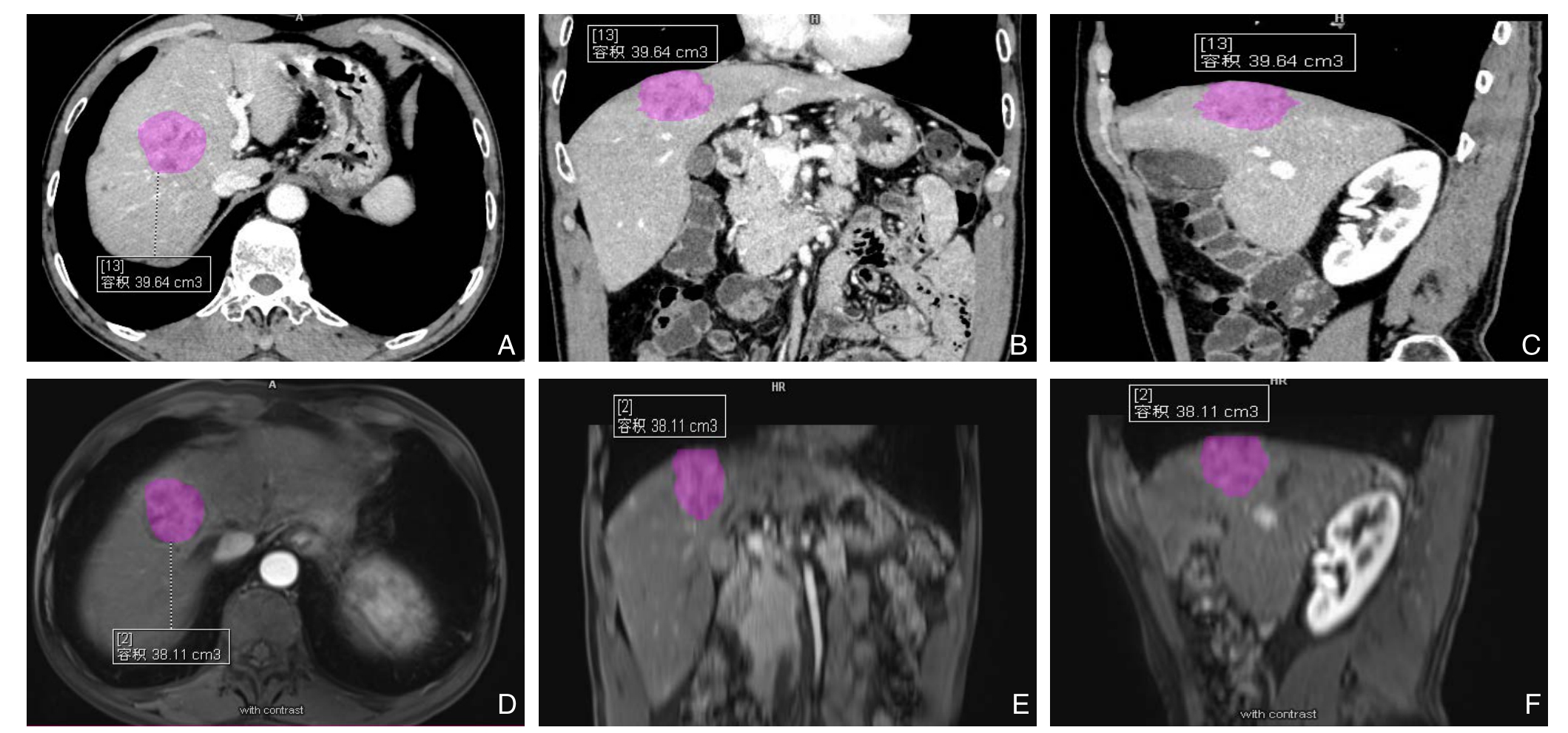
图1 区域生长ACM分割肝细胞癌的体积(图中紫色部) A-C:增强CT的体积测量图;D-F:CE-MRI的体积测量图
Figure1 HCC lesion segmentation with region-based ACM (purple portions) A-C:The volume measurement image by enhanced CT;D-F:The volume measurement image by CE-MRI
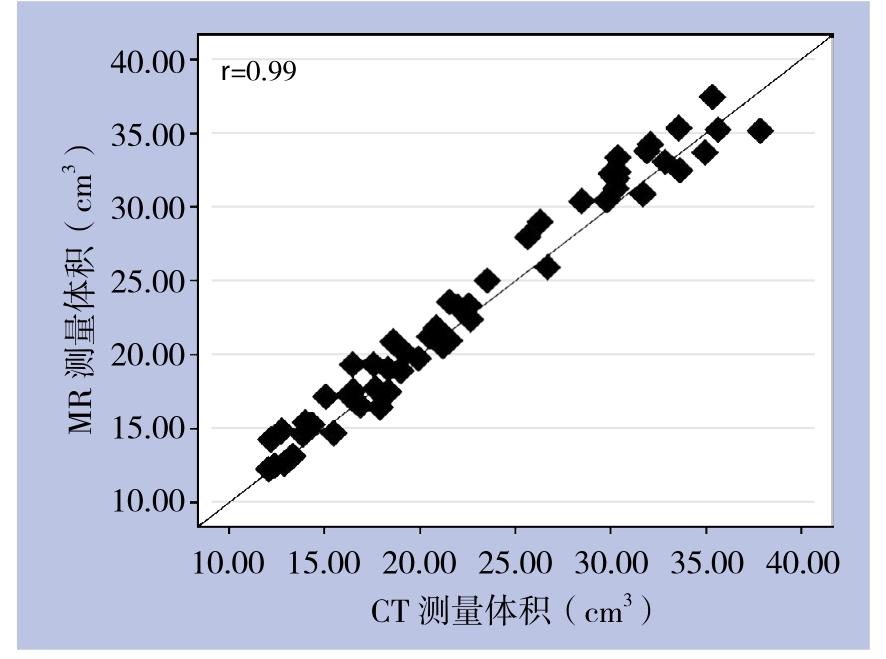
图2 CE-MRI测量体积与增强CT测量体积的相关性分析
Figure2 Correlation analysis of tumor volumes obtained by CE-MRI and contrast-enhanced CT
3 讨 论
3.1 肝细胞癌体积评估的重要性
肝体积计算和虚拟肝切除术对于肝癌精准肝切除术的手术方案选择有重要价值[9]。根据增强CT或CE-MRI的扫描图像来进行术前精准体积测量,对于安全实施复杂肝脏切除手术的作用至关重要,计算肝脏切除体积与残余肝体积,仔细观察测量计划与周围解剖结构的关系[10],得到手术前、后的肝脏肿块体积以及残余肝脏体积数据,对于肝脏肿瘤切除、肝移植等手术的患者非常有必要,有助于减少因术后残肝体积过小而造成的各种并发症。
肝脏肿块体积评估有助于间接评估肝储备功能,术后测量残余肝脏体积,有助于外科医生了解肝脏的再生情况[11]。
3.2 基于区域生长ACM测量肝癌体积的优势
肝细胞癌体积区域生长ACM允许结合软件改善工作流程,提高效率,提高阅片准确性。相反,手动分割需要更多时间,高水平专业知识,以及对图像功能的良好了解。区域生长ACM分割软件综合了肿瘤的复杂外形,邻近结构,不同程度的增强,和相邻的伪影。在本研究中,区域生长ACM体积分割软件成功应用于用二种成像方式分割肿瘤。
区域生长ACM有助于更准确地识别肿瘤反应,并用于评估肝细胞癌在TACE(经导管肝动脉化疗栓塞)之后的影像学改变,本研究表明在CEMRI和增强CT图像上基于区域生长主动轮廓模型切割方法获得的肿瘤体积数据具有强相关性。使用三维区域生长ACM肿瘤分割进行肿瘤体积测量可能比一维和二维测量方法更准确[12-13]。
3.3 关于肿瘤体积计算的图像分割方法
3D可视化技术可以计算剩余肝脏体积,并可提高中央型肝肿瘤肝切除手术前规划的准确率及帮助术中精确操作[13]。有几种半自动图像分割技术已经应用于肿瘤体积分析[14-16]。区域生长算法是最常用的方法,也是CT图像后处理技术的重要方法。区域生长算法的基本原理是将有相似性质的像素点合并到一起。对每一个区域要先指定一个种子点作为生长的起点,然后将种子点周围区域的像素点和种子点进行对比,将具有相似性质的点合并起来继续向外生长,直到满足条件的像素被包括进来为止,这样一个区域的生长就完成了[17-18]。在使用中,它依赖于肝细胞癌图像的形状和线性的组合。每个形状都建立在3D区域图像的特征上,其中心位置和大小由操作者划定。这些图形通过基于图像的标准优化结合在一起,可以设置增长的灵敏度包含或排除新形状,自动控制整体组合最终实现体积分割。
肝细胞癌体积区域生长ACM切割方法是在三维图像上基于阈值区域生长获得一层图像中肝细胞癌病变的初始轮廓,再利用ACM获得该层的结果,然后将分割结果作为相邻层图像的初始轮廓进行ACM分割,通过迭代算法,实现对肿瘤在一组三维图像序列的切割[19]。在此基础上,该算法利用肝脏轮廓位置获得肝脏肿瘤位置的临界值,再将肝脏肿瘤数据分割出来,从而实现肝脏肿瘤边界的半自动分割,计算肿块体积[20]。
3.4 国际上肿瘤体积分割技术在评估TACE对肿瘤反应的应用趋势
当今国际上广泛应用的评估T A C E对肿瘤反应的方法包括:实体肿瘤反应的评估标准(Response Evaluation Criteria in Solid Tumor,RECIST)[20-21];欧洲肝脏研究协会(European Association for the Study of the Liver,EASL)的指南[22-23];修改后的RECIST(mRECIST)[24-25]评估标准。基于病灶直径的RECIST评估标准用于测量整体肿瘤大小的变化,EASL则用于测量肿瘤增强的区域,而mRECIST测量肿瘤增强直径最大值。实际上这3种评估方法都是一维或者二维的测量方法,都不能精确的评估肿瘤体积变化情况[26]虽然目前在临床上RECIST、EASL、mRECIST仍是评估TACE治疗反应的3种公认方法,但这3种方法在实际应用中都表现出了比较大的局限性[27]。TACE栓塞肿瘤血供引起的肿瘤部分坏死,导致肿瘤实质不均匀强化和瘤体大小形态不规则,导致评估TACE肿瘤反应的3种方法得出的结果误差较大,一定程度上影响了临床医生对患者治疗效果的判断[28]。近来,国际上提出了一种新的评估方法——容量评估。它是通过半自动肿瘤切割来完成的,具体做法为:⑴ 确定整个肿瘤体积;⑵ 确定增强肿瘤体积;⑶ 确定增强肿瘤体积的百分比。并且把这些方法称为定量EASL(QEASL)和体积RECIST(VRECIST)[29]。这些方法,可以比较准确的测量肿瘤体积的大小,并且通过比较治疗前后肿瘤体积大小的变化帮助临床医生精准判断治疗的效果[30]
3.5 在增强CT和CE-MRI图像上进行肝细胞癌体积测量一致性研究的意义
在实际工作中发现部分患者在治疗前后所采用的肝脏影像学检查并不一致,由于检查费用控制,部分患者首诊和复查随访时仅选择做增强CT或者CE-MRI检查,两种检查并不全做。这就给临床医生带来了困惑,两种不同的影像学检查所测出的肿瘤体积数据是否具有一致性?虽然大家主观上都认为应该基本一致,但缺少研究数据的支撑。为了解决证实这一问题,本研究回顾性分析了60例患者的60个靶病灶,均同时进行了增强CT和增强MRI扫描,再把数据导入后处理工作站通过半自动肿瘤分割软件进行肿瘤体积测算,发现通过两种不同影像学检查方法所得到的数据算出的肿瘤体积具有高度一致性,从而证实了这一判断,解决了临床医生在这一问题上的困扰。
本研究也有一定的局限性,本次研究所选取的靶病灶都是轮廓比较清晰的病灶,对于有多发转移及浸润性病灶,并且伴有门静脉癌栓的患者,通过区域生长主动轮廓模型肿瘤分割来精准测量肿瘤体积仍有较大的困难,如何进行全肝多发及浸润肿瘤病灶体积测量,这也是今后研究的方向。
[1]Forner A,Reig M,Bruix J.Hepatocellular carcinoma[J].Lancet,2018,391(10127):1301-1314.doi:10.1016/S0140-6736(18)30010-2.
[2]Swaid F,Geller DA.Minimally Invasive Primary Liver Cancer Surgery[J].Surg Oncol Clin N Am,2019,28(2):215-227.doi:10.1016/j.soc.2018.11.002.
[3]王然,祁兴顺,郭晓仲.肝脏影像报告和数据系统管理工作组肝细胞癌诊断共识意见[J].临床肝胆病杂志,2015,31(11):1791-1795.doi:10.3969/j.issn.1001-5256.2015.11.006.
Wang R,Qi XS,Guo XZ.LI-RADS Management Working Group consensus on the diagnosis of hepatocellular carcinoma[J].Journal of Clinical Hepatology,2015,31(11):1791-1795.doi:10.3969/j.issn.1001-5256.2015.11.006.
[4]中华医学会数字医学分会,中国研究型医院学会数字医学临床外科专业委员会.复杂性肝脏肿瘤三维可视化精准诊治专家共识[J].中国实用外科杂志,2017,37(1):53-59.doi:10.19538/j.cjps.issn1005-2208.2017.01.18.
Chinese Society of Digital Medicine,Digital Surgery Committee of Chinese Research Hospital Association.Expert consensus on 3-D visualized precision diagnosis and treatment of complicated liver tumors[J].Chinese Journal of Practical Surgery,2017,37(1):53-59.doi:10.19538/j.cjps.issn1005-2208.2017.01.18.
[5]Jiang JM,Ohri N,Tang J,et al.Centers with more therapeutic modalities are associated with improved outcomes for patients with hepatocellular carcinoma[J].J Gastrointest Oncol,2019,10(3):546-553.doi:10.21037/jgo.2019.01.30.
[6]Lee GC,Ferrone CR,Vagefi PA,et al.Surgical resection versus ablation for early-stage hepatocellular carcinoma:A retrospective cohort analysis[J].Am J Surg,2019,218(1):157-163.doi:10.1016/j.amjsurg.2018.12.067.
[7]Fu S,Chen S,Liang C,et al.Texture analysis of intermediateadvanced hepatocellular carcinoma:prognosis and patients'selection of transcatheter arterial chemoembolization and sorafenib[J].Oncotarget,2017,8(23):37855-37865.doi:10.18632/oncotarget.13675.
[8]Wang Z,Chapiro J,Schernthaner R,et al.Multimodality 3D Tumor Segmentation in HCC Patients Treated with TACE[J].Acad Radiol,2015,22(7):840-845.doi:10.1016/j.acra.2015.03.001
[9]白军军,李航,孙宝震,等.数字化三维重建技术在肝癌精准肝切除术中的应用[J].中国普通外科杂志,2018,27(7):826-833.doi:10.3978/j.issn.1005-6947.2018.07.005.
Bai JJ,Li H,Sun BZ,et al.Application of digital 3D reconstruction technique in precise hepatectomy for liver cancer[J].Chinese Journal of General Surgery,2018,27(7):826-833.doi:10.3978/j.issn.1005-6947.2018.07.005.
[10]徐安书,傅朝春,韦萍,等.3D打印技术在精准切除治疗肝脏肿瘤中的应用[J].中国普通外科杂志,2018,27(1):29-34.doi:10.3978/j.issn.1005-6947.2018.01.005.
Xu AS,Fu CC,Wei P,et al.Application of 3D printing technology in precision resection of liver tumors[J].Chinese Journal of General Surgery,2018,27(1):29-34.doi:10.3978/j.issn.1005-6947.2018.01.005.
[11]Zeng YZ,Liao SH,Tang P,et al.Automatic liver vessel segmentation using 3D region growing and hybrid active contour model[J].Comput Biol Med,2018,97:63-73.doi:10.1016/j.compbiomed.2018.04.014.
[12]Esfandiarkhani M,Foruzan A H.A generalized active shape model for segmentation of liver in low-contrast CT volumes[J].Comput Biol Med,2017,82:59-70.doi:10.1016/j.compbiomed.2017.01.009.
[13]袁荣发,闵家祺,邬林泉,等.3D技术在中央型肝肿瘤术前规划中的临床应用[J].中国普通外科杂志,2018,27(7):818-825.doi:10.3978/j.issn.1005-6947.2018.07.004.
Yuan RF,Min JQ,Wu LQ,et al.Clinical application of 3D technology in preoperative surgical planning for central liver tumor[J].Chinese Journal of General Surgery,2018,27(7):818-825..doi:10.3978/j.issn.1005-6947.2018.07.004.
[14]Press RH,Shu HG,Shim H,et al.The Use of Quantitative Imaging in Radiation Oncology:A Quantitative Imaging Network (QIN)Perspective[J].Int J Radiat Oncol Biol Phys,2018,102(4):1219-1235.doi:10.1016/j.ijrobp.2018.06.023.
[15]Farahani K,Tata D,Nordstrom RJ.QIN Benchmarks for Clinical Translation of Quantitative Imaging Tools[J].Tomography,2019,5(1):1-6.doi:10.18383/j.tom.2018.00045.
[16]Wang Z,Zhang C,Jiao T,et al.Fully Automatic Segmentation and Three-Dimensional Reconstruction of the Liver in CT Images[J].J Healthc Eng,2018,2018:6797102.doi:10.1155/2018/6797102.
[17]乐美琰,魏千越,邓炜,等.基于电子计算机断层扫描图像的肝癌病灶自动分割方法研究进展[J].生物医学工程学杂志,2018,35(3):481-487.doi:10.7507/1001-5515.201708009.
Yue MY,Wei QY,Deng W,et al.A review of automatic liver tumor segmentation based on computed tomography[J].Journal of Biomedical Engineering,2018,35(3):481-487.doi:10.7507/1001-5515.201708009.
[18]Jiang H,Li S,Li S.Registration-Based Organ Positioning and Joint Segmentation Method for Liver and Tumor Segmentation[J].Biomed Res Int,2018,2018:8536854.doi:10.1155/2018/8536854.
[19]Chung M,Lee J,Chung JW,et al.Accurate liver vessel segmentation via active contour model with dense vessel candidates[J].Comput Methods Programs Biomed,2018,166:61-75.doi:10.1016/j.cmpb.2018.10.010.
[20]Morse B,Jeong D,Ihnat G,et al.Pearls and pitfalls of response evaluation criteria in solid tumors (RECIST) v1.1 non-target lesion assessment[J].Abdom Radiol (NY),2019,44(2):766-774.doi:10.1007/s00261-018-1752-4.
[21]Kuhl CK,Alparslan Y,Schmoee J,et al.Validity of RECIST Version 1.1 for Response Assessment in Metastatic Cancer:A Prospective,Multireader Study[J].Radiology,2019,290(2):349-356.doi:10.1148/radiol.2018180648.
[22]Meng XC,Chen BH,Huang JJ,et al.Early prediction of survival in hepatocellular carcinoma patients treated with transarterial chemoembolization plus sorafenib[J].World J Gastroenterol,2018,24(4):484-493.doi:10.3748/wjg.v24.i4.484.
[23]Wang W,Bai W,Wang E,et al.mRECIST response combined with sorafenib-related adverse events is superior to either criterion alone in predicting survival in HCC patients treated with TACE plus sorafenib[J].Int J Cancer,2017,140(2):390-399.doi:10.1002/ijc.30451.
[24]Liu L,Wang W,Chen H,et al.EASL- and mRECIST-evaluated responses to combination therapy of sorafenib with transarterial chemoembolization predict survival in patients with hepatocellular carcinoma[J].Clin Cancer Res,2014,20(6):1623-1631.doi:10.1158/1078-0432.CCR-13-1716.
[25]Lim TS,Rhee H,Kim GM,et al.Alpha-Fetoprotein,Des-Gamma-Carboxy Prothrombin,and Modified RECIST Response as Predictors of Survival after Transarterial Radioembolization for Hepatocellular Carcinoma[J].J Vasc Interv Radiol,2019,pii:S1051-0443(19)30363-X.doi:10.1016/j.jvir.2019.03.016.[Epub ahead of print]
[26]Zhao Y,Duran R,Bai W,et al.Which Criteria Applied in Multi-Phasic CT Can Predict Early Tumor Response in Patients with Hepatocellular Carcinoma Treated Using Conventional TACE:RECIST,mRECIST,EASL or qEASL?[J].Cardiovasc Intervent Radiol,2018,41(3):433-442.doi:10.1007/s00270-017-1829-4.
[27]Vande Lune P,Abdel Aal AK,Klimkowski S,et al.Hepatocellular Carcinoma:Diagnosis,Treatment Algorithms,and Imaging Appearance after Transarterial Chemoembolization[J].J Clin Transl Hepatol,2018,6(2):175-188.doi:10.14218/JCTH.2017.00045.
[28]Smolka S,Chapiro J,Manzano W,et al.The impact of antiangiogenic therapy combined with Transarterial Chemoembolization on enhancement based quantitative tumor response assessment in patients with hepatocellular carcinoma[J].Clin Imaging,2017,46:1-7.doi:10.1016/j.clinimag.2017.05.007.
[29]Fleckenstein FN,Schernthaner RE,Duran R,et al.3D Quantitative tumour burden analysis in patients with hepatocellular carcinoma before TACE:comparing single-lesion vs.multi-lesion imaging biomarkers as predictors of patient survival[J].Eur Radiol,2016,26(9):3243-3252.doi:10.1007/s00330-015-4168-3.
[30]Kim KA,Choi SY,Kim MU,et al.The Efficacy of Cone-Beam CT-Based Liver Perfusion Mapping to Predict Initial Response of Hepatocellular Carcinoma to Transarterial Chemoembolization[J].J Vasc Interv Radiol,2019,30(3):358-369.doi:10.1016/j.jvir.2018.10.002.
