过去几十年以来,甲状腺癌的发病率稳步上升[1-3]。根据美国国家癌症研究所的监测、流行病学和最终结果(SEER)数据库[4-6],2015年甲状腺癌的总发病率为15.04例/10万人。绝大多数(>90%)的甲状腺恶性肿瘤是分化型甲状腺癌,起源于甲状腺滤泡上皮,分化型甲状腺癌中乳头状甲状腺癌占85%~90%,滤泡状甲状腺癌占5%~10%[7]。近年来甲状腺癌总发病率的增加主要是由于乳头状甲状腺癌的发病率明显上升[8]。分化型甲状腺癌的主要治疗方法是手术[9-13],超声检查是术前确定淋巴结转移的主要手段[14-18],基于此,本研究旨在探讨分化型甲状腺癌术前原发肿物超声特征与术后颈部淋巴结转移的关系,以其为临床医生制定合适的手术方式提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2016年5月—2018年5月于我院经手术病理证实为分化型甲状腺癌的217例患者临床资料。纳入标准:⑴患者年龄18~75岁;⑵术前行超声检查并经手术病理证实为分化型甲状腺癌[19]。排除标准:合并其他器官或脏器恶性肿瘤者;有甲状腺手术病史;既往采用碘131治疗。本研究经过本院伦理委员会评审和批准,且所有患者对本研究知情同意。217例患者中男68例,女149例;年龄18~74岁,平均年龄(44.5±9.7)岁;术后病理:乳头状癌212例,滤泡状癌5例。101例发生淋巴结转移(转移组);116例未发生淋巴结转移(对照组)。
1.2 检测仪器
采用Philips EPIQ7,GE Logiq 9彩色多普勒超声诊断仪,探头频率为5~12 MHz。
1.3 观察指标
评估患者甲状腺和双侧颈部淋巴结的具体情况,统计淋巴结收缩期最高流速、搏动指数、阻力指数,分析甲状腺原发肿物的部位、数目、大小、纵横比、边缘、边界、与甲状腺被膜接触面积、内部回声、回声的均匀性、微钙化、内部血流情况与淋巴结转移的关系[20-26]。
1.4 淋巴结转移的诊断标准
⑴微小钙化灶;⑵液化或囊性区;⑶多发团片样高回声区;⑷血供丰富或较丰富;⑸淋巴结长短径比<2;⑹淋巴结结构欠清晰、淋巴门消失。具有⑴或⑵,或⑶~⑹中2个或2个以上即为转移淋巴结。
1.5 统计学处理
采用SPSS 20.0进行统计学分析本研究所得数据,计量资料采用均数±标准差( ±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
±s)表示,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 术前超声对分化型甲状腺癌患者颈部淋巴结转移的诊断性能
术前超声在转移组(n=101)中诊断正确92例,诊断错误9例;在对照组(n=116)中诊断正确110例,诊断错误6例。术前超声对分化型甲状腺癌颈部淋巴结转移的诊断敏感度、特异度、准确性、阳性预测值、阴性预测值、漏诊率、误诊率分别为91.1%(92/101)、94.8%(110/116)、93.1%(202/217)、93.9%(92/98)、92.4%(110/119)、8.9%(9/101)、5.2%(6/116)。
2.2 两组分化型甲状腺癌患者的颈部淋巴结超声特征比较
转移组患者淋巴结收缩期最高流速和搏动指数均高于对照组,差异有统计学意义(P<0.05)。两组阻力指数无统计学差异(P>0.05)(表1)。
表1 两组分化型甲状腺癌患者的颈部淋巴结超声特征比较( ±s)
±s)
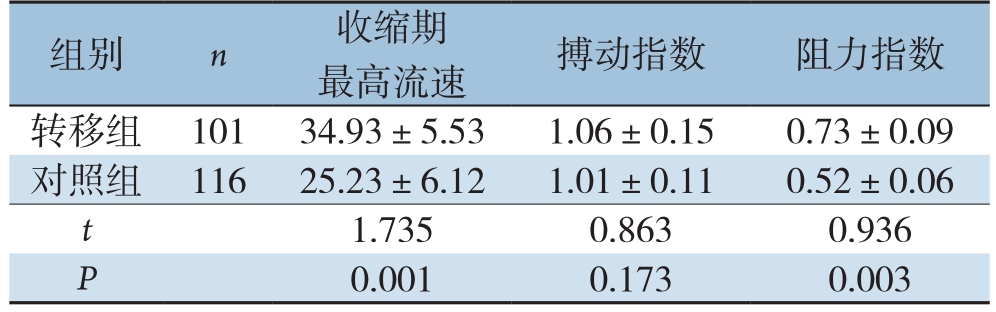
组别 n 收缩期最高流速 搏动指数 阻力指数转移组 10134.93±5.531.06±0.150.73±0.09对照组 11625.23±6.121.01±0.110.52±0.06 t 1.7350.8630.936 P 0.0010.1730.003
2.3 分化型甲状腺癌患者的临床特征、原发肿物超声特征与颈部淋巴结转移的单因素分析
转移组与对照组患者的性别与年龄的差异均无统计学意义(P>0.05);转移组原发肿物的部位、边缘、边界、内部回声、回声的均匀性与对照组均无统计学差异(P>0.05),但原发肿物的数目、大小、纵横比、与被膜接触面积、微钙化、内部血流与对照组比较有统计学差异(P<0.05)(表2)。
2.4 分化型甲状腺癌患者原发肿物超声特征与颈部淋巴结转移的多因素分析
Logistic回归分析结果显示,原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富为分化型甲状腺癌患者颈部淋巴结转移的独立危险因素(P<0.05),原发肿物数目、大小、纵横比与分化型甲状腺癌患者颈部淋巴结转移关系不明显(P>0.05)(表3)。
表2 分化型甲状腺癌患者的临床特征、原发肿物超声特征与颈部淋巴结转移的单因素分析[n(%)]

项目 转移组(n=101)对照组(n=116) χ2 P临床特征性别男36(35.6) 32(27.6) 3.735 >0.05女65(64.4) 84(72.4)年龄(岁)<4542(41.6) 47(40.5) 4.622 >0.05≥4559(58.4) 69(59.5)原发肿物超声特征部位上级 12(11.9) 19(16.4)中级 44(43.6) 50(43.1) 0.573 >0.05下级 45(44.6) 47(40.5)数目(枚)174(73.3) 88(75.9) 9.654 <0.05>127(26.7) 28(24.1)大小(cm)≤112(11.9) 60(51.7) 4.163 <0.05>189(88.1) 56(48.3)纵横比<121(20.8) 48(41.4) 8.112 <0.05≥180(79.2) 68(58.6)边缘规则 4(3.4) 10(8.6) 1.632 >0.05欠规则 97(96.0) 106(91.4)边界清晰 26(25.7) 39(33.6) 0.512 >0.05欠清晰 75(74.3) 77(66.4)与被膜接触面积侵犯 71(70.3) 31(26.7) 7.511 <0.05未侵犯 30(29.7) 85(73.3)内部回声囊实性 39(38.6) 46(39.7) 0.762 >0.05实性 62(61.4) 70(60.3)回声的均匀性均匀 31(30.7) 36(31.0) 1.823 >0.05不均匀 70(69.3) 80(69.0)微钙化有81(80.2) 69(59.5) 9.513 <0.05无20(19.8) 47(40.5)内部血流丰富 57(56.4) 38(32.8) 6.493 <0.05少或无 44(43.6) 78(67.2)
表3 分化型甲状腺癌患者原发肿物超声特征与颈部淋巴结转移的多因素分析
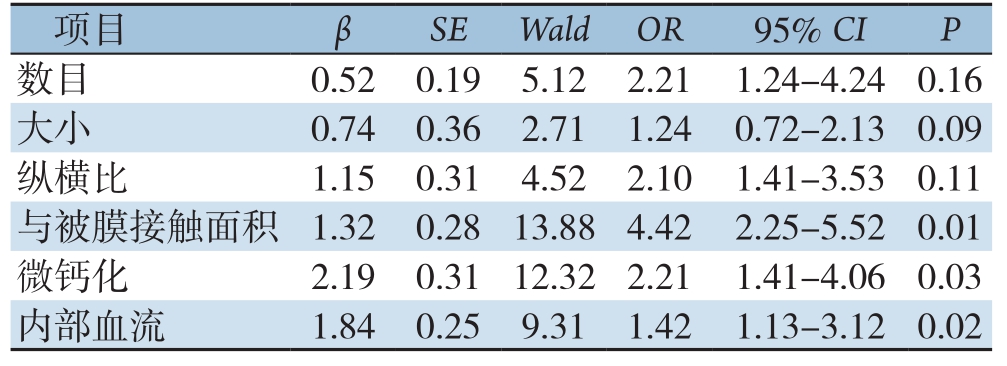
项目 β SE Wald OR 95% CI P数目 0.520.195.122.211.24-4.240.16大小 0.740.362.711.240.72-2.130.09纵横比 1.150.314.522.101.41-3.530.11与被膜接触面积 1.320.2813.884.422.25-5.520.01微钙化 2.190.3112.322.211.41-4.060.03内部血流 1.840.259.311.421.13-3.120.02
3 讨 论
全世界甲状腺癌的发病率一直在上升。在美国,2016年男性和女性甲状腺癌新发病例超过64300例,死亡1980例,患者易发生颈淋巴结转移[27]。通过适当的规范化治疗,如手术和放射性碘消融术,大多数分化型甲状腺癌患者的预后良好,10年生存率为80%~90%。尽管如此,高达20%的患者可能会发生局部复发,甚至少数患者会进展,导致致命性的结果。颈部淋巴结转移不仅影响分化型甲状腺癌的治疗策略,而且是分化型甲状腺癌的重要预后指标[4]。现代影像学的最新进展使人们能够准确地识别颈部淋巴结区内受累或可疑的淋巴结,由经验丰富的超声医生对颈部淋巴结进行仔细的辨识,有助于外科医生在术中进行定向的(或选择性的)淋巴结清扫,而不需要广泛的改良根治性淋巴结清扫[28]。为了给术中淋巴结的精准清扫提供指导依据,本文重点探讨分化型甲状腺癌术前原发肿物超声特征与术后颈部淋巴结转移的关系。
本研究结果显示,术前超声对分化型甲状腺癌颈部淋巴结转移的诊断敏感度、特异度、准确性、阳性预测值、阴性预测值、漏诊率、误诊率分别为91.1%(92/101)、94.8%(110/116)、93.1%(202/217)、93.9%(92/98)、92.4%(110/119)、8.9%(9/101)、5.2%(6/116)。可见术前超声成像诊断分化型甲状腺癌颈部淋巴结转移与病理诊断结果吻合度较高。既往有文献[29]报道术前超声诊断颈部淋巴结的诊断灵敏度为85.4%,略低于本文报道的91.1%,这可能是由于本研究中所有超声诊断均由2名副主任医师共同确认,故诊断性能稍高。还有研究[23]报道超声对颈部中央区淋巴结的诊断灵敏度为35.3%,这可能是由于中央区淋巴结位置较深,而本研究既包含颈侧区淋巴结,也包含中央区淋巴结,因此总体诊断率较高。
本研究中转移组患者淋巴结收缩期最高流速和搏动指数均高于对照组(P<0.05);两组阻力指数无统计学差异(P>0.05)。说明淋巴结收缩期最高流速和搏动指数对分化型甲状腺癌患者颈部淋巴结转移有重要的预测价值,也有研究[30]发现了这一现象,提示临床超声医生在检查时要注意关注收缩期最高流速和搏动指数指标的变化,以便及时筛查出已出现淋巴结转移的患者,为手术方案的准确制定提供科学依据。
进一步分析结果显示,转移组与对照组患者的性别与年龄的差异均无统计学意义(P>0.05)。转移组原发肿物的部位、边缘、边界、内部回声、回声的均匀性与对照组均无统计学差异(P>0.05),但原发肿物的数目、大小、纵横比、与被膜接触面积、微钙化、内部血流与对照组相比差异显著(P<0.05)。Logistic回归分析结果显示,原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富为分化型甲状腺癌患者颈部淋巴结转移的独立危险因素(P<0.05),原发肿物数目、大小、纵横比与颈部淋巴结转移关系不明显(P>0.05)。赵博等[21]研究证实患者年龄(<45岁)、甲状腺原发肿物侵犯或紧邻甲状腺被膜以及肿物的丰富血流为分化型甲状腺癌颈部淋巴结转移的独立危险因素,而在本研究中并未发现年龄因素对淋巴结转移的影响,可能与他们的研究中纳入的年轻患者较多有关,也体现出目前分化型甲状腺癌的发病率呈年轻化态势。王晓庆等[23]研究发现,直径>1 cm、微小钙化、被膜侵及的长度/结节周长≥1/4时,伴颈部淋巴结转移的风险较大。殷德涛等[20]研究结果与本文一致,未发现性别、年龄、病灶大小与淋巴结转移的关系,多项研究[21-23]都证实原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富的患者极易发生淋巴结转移,这可能是因为:⑴甲状腺恶性程度较高时,癌细胞繁殖速度较快,向甲状腺包膜外侵袭的程度会更深[21],更易发生淋巴结转移;⑵砂粒体前体由肿瘤细胞中完整的蛋白质组成,释放到局部组织中继而发生钙化,肿瘤内砂粒体可随着肿瘤细胞通过血运或淋巴转移至结节外的腺体或颈部淋巴结[22];⑶肿物内部血流丰富一般提示结节较大,且恶性程度高[23],因此淋巴结转移的可能性更大。
综上所述,分化型甲状腺癌原发肿物侵犯甲状腺被膜、微钙化、内部血流丰富为分化型甲状腺癌患者颈部淋巴结转移的高危因素,临床针对此类患者,术前超声医生应更仔细地寻找淋巴结转移征象,关注收缩期最高流速和搏动指数指标的变化,对淋巴结进行术前定性、定量、定位,外科医生应据此制定精准化、个性化的手术方案。因此,多学科协作对于优化分化型甲状腺癌患者的管理至关重要。未来我们将从早期诊断、有效治疗及随访和预后评估等多方面入手[31-34],为分化型甲状腺癌的治疗和预后提供更高质量的医疗服务。
[1]Davies L,Morris LG,Haymart M,et al.American association of clinical endocrinologists and american college of endocrinology disease state clinical review:the increasing incidence of thyroid cancer[J].Endocr Pract,2015,21(6):686-696.doi:10.4158/EP14466.DSCR.
[2]Howlader NN,Krapcho M,Miller D.SEER Cancer Statistics Review,1975-2014[EB].Available at https://seer.cancer.gov/csr/1975_2014/.
[3]Katoh H,Yamashita K,Enomoto T,et al.Classi fication and general considerations of thyroid cancer[J].Ann Clin Pathol,2015,3:1045.
[4]Kitahara CM,Sosa JA.The changing incidence of thyroid cancer[J].Nat Rev Endocrinol,2016,12(11):646-653.doi:10.1038/nrendo.2016.110.
[5]Seib CD,Sosa JA.Evolving understanding of the epidemiology of thyroid cancer[J].Endocrinol Metab Clin North Am,2019,48(1):23-35.doi:10.1016/j.ecl.2018.10.002.
[6]Smittenaar CR,Petersen KA,Stewart K,et al.Cancer incidence and mortality projections in the UK until 2035[J].Br J Cancer,2016,115(9):1147-1155.doi:10.1038/bjc.2016.304.
[7]Aboelnaga EM,Ahmed RA.Difference between papillary and follicular thyroid carcinoma outcomes:an experience from Egyptian institution[J].Cancer Biol Med,2015,12(1):53-59.doi:10.7497/j.issn.2095-3941.2015.0005.
[8]Haugen BR,Alexander EK,Bible KC,et al.2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer:The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer[J].Thyroid,2016,26(1):1-133.doi:10.1089/thy.2015.0020.
[9]Pacini F,Basolo F,Bellantone R,et al.Italian consensus on diagnosis and treatment of differentiated thyroid cancer:joint statements of six Italian societies[J].J Endocrinol Invest,2018,41(7):849-876.doi:10.1007/s40618-018-0884-2.
[10]Cheng SP,Chien MN,Wang TY,et al.Reconsideration of tumor size threshold for total thyroidectomy in differentiated thyroid cancer[J].Surgery,2018,164(3):504-510.doi:10.1016/j.surg.2018.04.019.
[11]Gonçalves Filho J,Zafereo ME,Ahmad FI,et al.Decision making for the central compartment in differentiated thyroid cancer[J].Eur J Surg Oncol,2018,44(11):1671-1678.doi:10.1016/j.ejso.2018.08.005.
[12]Yan H,Winchester DJ,Prinz RA,et al.Differences in the impact of age on mortality in well-differentiated thyroid cancer[J].Ann Surg Oncol,2018,25(11):3193-3199.doi:10.1245/s10434-018-6668-2.
[13]Amit M,Boonsripitayanon M,Goepfert RP,et al.Extrathyroidal extension:does strap muscle invasion alone influence recurrence and survival in patients with differentiated thyroid cancer?[J].Ann Surg Oncol,2018,25(11):3380-3388.doi:10.1245/s10434-018-6563-x.
[14]Grasso M,Puzziello A,De Palma M.Preoperative ultrasound evaluation of laterocervical lymph nodes:timing and experience modify the treatment of patients with differentiated thyroid cancer[J].Updates Surg,2019.doi:10.1007/s13304-018-00618-9.[Epub ahead of print]
[15]Gray JL,Singh G,Uttley L,et al.Routine thyroglobulin,neck ultrasound and physical examination in the routine follow up of patients with differentiated thyroid cancer-Where is the evidence?[J].Endocrine,2018,62(1):26-33.doi:10.1007/s12020-018-1720-3.
[16]Oltmann SC,Schneider DF,Chen H,et al.All thyroid ultrasound evaluations are not equal:sonographers specialized in thyroid cancer correctly label clinical N0 disease in well differentiated thyroid cancer[J].Ann Surg Oncol,2015,22(2):422-428.doi:10.1245/s10434-014-4089-4.
[17]Wang LY,Palmer FL,Thomas D,et al.Preoperative neck ultrasound in clinical node-negative differentiated thyroid cancer[J].J Clin Endocrinol Metab,2014,99(10):3686-3693.doi:10.1210/jc.2014-1681.
[18]Lepoutre-Lussey C,Maddah D,Golmard JL,et al.Post-operative neck ultrasound and risk stratification in differentiated thyroid cancer patients with initial lymph node involvement[J].Eur J Endocrinol,2014,170(6):837-846.doi:10.1530/EJE-13-0888.
[19]Ghaznavi SA,Ganly I,Shaha AR,et al.Using the American Thyroid Association Risk-Stratification System tORefine and Individualize the American Joint Committee on Cancer Eighth Edition Disease-Specific Survival Estimates in Differentiated Thyroid Cancer[J].Thyroid,2018,28(10):1293-1300.doi:10.1089/thy.2018.0186.
[20]殷德涛,韩飏,张亚原,等.多灶性甲状腺乳头状癌的临床病理及颈淋巴结转移特征[J].中国普通外科杂志,2017,26(5):556-560.doi:10.3978/j.issn.1005-6947.2017.05.004.Yin DT,Han Y,Zhang YY,et al.Clinicopathologic and neck metastasis features of multifocal papillary thyroid cancer[J].Chinese Journal of General Surgery,2017,26(5):556-560.doi:10.3978/j.issn.1005-6947.2017.05.004.
[21]赵博,胡静,王金锐,等.分化型甲状腺癌临床及超声特征与颈部淋巴结转移的相关性分析[J].中国超声医学杂志,2017,33(6):488-491.doi:10.3969/j.issn.1002-0101.2017.06.003.Zhao B,Hu J,Wang JR,et al.Correlation Analysis of Clinical and Ultrasonic Features of Differentiated Thyroid Carcinoma with Cervical Lymph Node Metastasis[J].Chinese Journal of Ultrasound Medicine,2017,33(6):488-491.doi:10.3969/j.issn.1002-0101.2017.06.003.
[22]张剑,王跃涛,徐斌,等.甲状腺微小乳头状癌原发灶超声特征与颈部淋巴结转移的关系[J].中国医学影像学杂志,2016,24(8):573-577.doi:10.3969/j.issn.1005-5185.2016.08.004.Zhang J,Wang YT,Xu B,et al.Correlation Between Sonographic Features of Primary Papillary Thyroid Microcarcinoma and Cervical Lymph Node Metastasis[J].Chinese Journal of Medical Imaging,2016,24(8):573-577.doi:10.3969/j.issn.1005-5185.2016.08.004.
[23]王晓庆,魏玮,魏玺,等.甲状腺乳头状癌的超声表现及其与颈部中央区淋巴结转移的关系[J].中华肿瘤杂志,2018,40(3):196-200.doi:10.3760/cma.j.issn.0253-3766.2018.03.007.Wang XQ,Wei W,Wei X,et al.Study on the relationship between ultrasonographic features of papillary thyroid carcinoma and central cervical lymph node metastasis[J].Chinese Journal of Oncology,2018,40(3):196-200.doi:10.3760/cma.j.issn.0253-3766.2018.03.007.
[24]马云海,程若川.甲状腺癌的超声管理——外科医生的基本功[J].中国普通外科杂志,2017,26(5):551-555.doi:10.3978/j.issn.1005-6947.2017.05.003.Ma YH,Cheng RC.Ultrasound management of thyroid cancer——basic clinical skill of surgeons[J].Chinese Journal of General Surgery,2017,26(5):551-555.doi:10.3978/j.issn.1005-6947.2017.05.003.
[25]陈名正,符尚宏,王雪峰.甲状腺肿瘤的超声诊断分析[J].中国普通外科杂志,2016,25(11):1666-1670.doi:10.3978/j.issn.1005-6947.2016.11.025.Chen MZ,Fu SH,Wang XF.Analysis of ultrasonographic diagnosis of thyroid cancer[J].Chinese Journal of General Surgery,2016,25(11):1666-1670.doi:10.3978/j.issn.1005-6947.2016.11.025.
[26]关海霞,梁楠.分化型甲状腺癌的动态风险评估——从疾病特点出发的新理念[J].中国普通外科杂志,2016,25(11):1536-1543.doi:10.3978/j.issn.1005-6947.2016.11.003.Guan HX,Liang N.Dynamic risk stratification of differentiated thyroid cancer:a new concept that arose from the view of disease characteristics[J].Chinese Journal of General Surgery,2016,25(11):1536-1543.doi:10.3978/j.issn.1005-6947.2016.11.003.
[27]Davies L,Welch HG.Current thyroid cancer trends in the United States[J].JAMA Otolaryngol Head Neck Surg,2014,140(4):317-322.doi:10.1001/jamaoto.2014.1.
[28]Sakorafas GH,Koureas A,Mpampali I,et al.Patterns of lymph node metastasis in differentiated thyroid cancer;clinical implications with particular emphasis on the emerging role of compartment-oriented lymph node dissection[J].Oncol Res Treat,2019,42(3):143-147.doi:10.1159/000488905.
[29]赵博,王金锐,胡静,等.术前超声在分化型甲状腺癌淋巴结手术选择中的临床价值[J].中国超声医学杂志,2014,30(11):964-967.Zhao B,Wang JR,Hu J,et al.Value of Preoperative Ultrasonography in Cervical Lymph Node Dissection of Differentiated Thyroid Carcinoma[J].Chinese Journal of Ultrasound Medicine,2014,30(11):964-967.
[30]杨方,王学梅,张浩,等.多普勒血流动力学指标诊断甲状腺乳头状癌颈部淋巴结转移的价值[J].中国医学影像技术,2012,28(5):873-876.Yang F,Wang XM,Zhang H,et al.Value of CDfihemodynamic parameters in diagnosing cervical lymph node metastasis of papillary thyroid carcinoma[J].Chinese Medical Imaging Technology,2012,28(5):873-876.
[31]于洋,关海霞.分化型甲状腺癌的术前分子诊断的发展现状及前景思考[J].中国普通外科杂志,2018,27(5):622-628.doi:10.3978/j.issn.1005-6947.2018.05.015.Yu Y,Guan HX.Preoperative molecular diagnosis of differentiated thyroid cancer:development status and future prospects[J].Chinese Journal of General Surgery,2018,27(5):622-628.doi:10.3978/j.issn.1005-6947.2018.05.015.
[32]程若川,刘文.鉴往知来:分化型甲状腺癌术后随访模式探索[J].中国普通外科杂志,2018,27(11):1370-1376.doi:10.7659/j.issn.1005-6947.2018.11.002.Cheng RC,Liu W.Envisioning the future by decoding the past:exploration of postoperative follow-up strategies for differentiated thyroid cancer[J].Chinese Journal of General Surgery,2018,27(11):1370-1376.doi:10.7659/j.issn.1005-6947.2018.11.002.
[33]程若川,刘文.中国甲状腺癌术后随访和临床研究现状反思[J].中国普通外科杂志,2017,26(11):1375-1382.doi:10.3978/j.issn.1005-6947.2017.11.002.Cheng RC,Liu W.Re fl ections on current problems in postoperative follow-up and clinical study of thyroid carcinoma in China[J].Chinese Journal of General Surgery,2017,26(11):1375-1382.doi:10.3978/j.issn.1005-6947.2017.11.002.
[34]孙永亮,杨志英,谭海东,等.甲状腺微小乳头状癌的诊治:附47例报告[J].中国普通外科杂志,2017,26(5):561-566.doi:10.3978/j.issn.1005-6947.2017.05.005.Sun YL,Yang ZY,Tan HD,et al.Diagnosis and treatment of papillary thyroid microcarcinoma:report of 47 cases[J].Chinese Journal of General Surgery,2017,26(5):561-566.doi:10.3978/j.issn.1005-6947.2017.05.005.
