肝癌作为常见恶性肿瘤受影响的因素较多,环境污染、乙肝感染、黄曲霉中毒等均可诱发本病。研究[1]提示肝硬化、肝炎等相关疾病的发生、发展均与原发性肝癌具有密切联系,但具体相关发病机制仍存在争议。肝癌的早期临床症状较为隐匿,确诊时多为晚期,多采用手术切除治疗,但治疗效果欠佳,因而本病的早期诊断及预后评估的研究具有重要意义。
Smads家族蛋白在将TGF-β信号从细胞表面受体传导至细胞核的过程中起到关键性作用,且不同的Smad介导不同的TGF-β家族成员的信号转导,其中Smad4被证实与肿瘤及多器官硬化具有密切联系[2];NF-κBp65已在多种肿瘤中被发现存在显著表达,但上述两种蛋白与肝癌的相关研究资料缺乏[3]。本研究探讨Smad4和NF-κBp65蛋白在肝癌中的表达及意义,报告如下。
1 资料与方法
1.1 一般资料
选取2016年7月—2017年12月在我院治疗的肝癌患者100例(观察组),其中男62例,女38例;年龄35~67岁,平均年龄(50.03±9.91)岁;合并HBV感染60例;CHILD分级:A级36例,B级44例,C级20例。纳入标准[4]:⑴ 均经病理组织学确诊原发性肝细胞癌;⑵ 术前未行放化疗等抗肿瘤治疗;⑶ 临床病理资料完整;⑷ 患者及家属知情同意。排除标准:⑴ 合并有其他恶性肿瘤者;⑵ 临床病理资料不完整。同时选取因肝血管瘤切除的正常肝组织标本42例作为对照组(排除合并有肝硬化、肝炎等其他疾病),两组受试者性别、年龄等一般资料比较差异均无统计学意义(均P>0.05)(表1)。
表1 两组一般资料比较
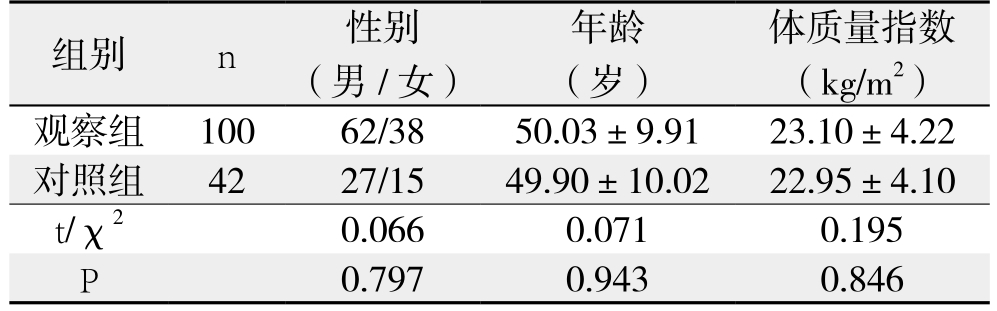
组别 n 性别(男/女)年龄(岁)体质量指数(kg/m2)观察组 100 62/38 50.03±9.91 23.10±4.22对照组 42 27/15 49.90±10.02 22.95±4.10 t/χ2 0.066 0.071 0.195 P 0.797 0.943 0.846
1.2 免疫组化染色
免疫组化染色法检测Smad4和NF-κBp65蛋白表达。使用Envision二步法进行,Smad4和NF-κBp65相关抗体购于美国Merck公司(批号20160521)。取所有患者及正常组织0.2 mg,常规石蜡包埋后切片后脱水,H2O2(3%)封闭后30 min内源性过氧化酶孵育,20 min微波修复,分别加入Smad4和NF-κBp65一抗(均稀释至1:1 000)后4 ℃过夜;常规PBS洗片分别加入HRP标记的兔抗鼠二抗;DAB显色后复染苏木素;常规脱水、透明后封片观察[5]。
1.3 结果判断
采用半定量积分法,随机选择5个高倍镜视野,分别计数200个细胞,对染色强度和阳性细胞比例进行评分,染色强度无着色为0分,黄色为1分,棕黄色为2分;阳性细胞比例≤25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;两者得分之积为最终得分,分数≥4分为阳性表达[6]。
1.4 统计学处理
统计分析采用SPSS 19.0软件,计量资料采用(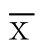 ±s)表示,两组间比较使用t检验,计数资料比较使用χ2检验,相关性采用Spearman秩相关分析。以P<0.05表示差异有统计学意义。
±s)表示,两组间比较使用t检验,计数资料比较使用χ2检验,相关性采用Spearman秩相关分析。以P<0.05表示差异有统计学意义。
2 结 果
2.1 观察组和对照组Smad4和NF-κBp65蛋白表达
观察组Smad4蛋白阳性表达率明显低于对照组(P<0.05),而NF-κBp65蛋白阳性表达率明显高于对照组(P<0.05)(表2)。
表2 观察组和对照组Smad4和NF-κBp65蛋白表达(%)
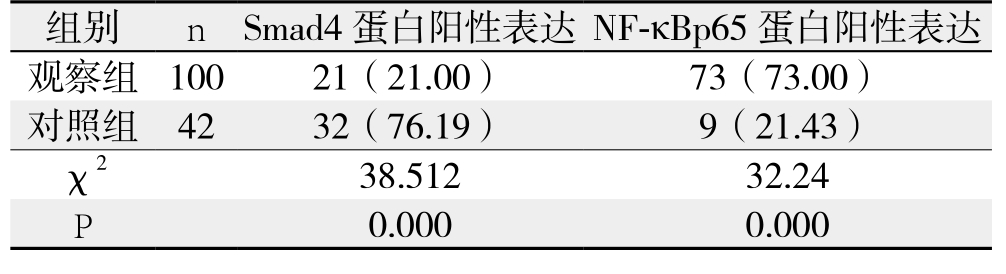
?

图1 观察组和对照组两种蛋白(免疫组化,×400) A:观察组Smad4蛋白表达;B:对照组Smad4蛋白表达;C:观察组NF-κBp65蛋白表达;D:对照组NF-κBp65蛋白表达
2.2 Smad4和NF-κBp65蛋白表达与患者临床病理特征
有淋巴结转移者Smad4蛋白阳性表达率明显低于无淋巴结转移患者(P<0.05);肿瘤直径>5 cm者NF-κBp65蛋白阳性表达率明显高于肿瘤直径≤5 cm者(P<0.05)(表3)。
表3 Smad4和NF-κBp65蛋白表达与患者临床病理特征关系[n(%)]

临床病理特征 n Smad4蛋白阳性表达 χ2 P NF-κBp65蛋白阳性表达 χ2 P年龄(岁)≤50 46 9(19.57) 0.106 0.745 32(69.57) 0.510 0.475> 50 54 12(22.22) 41(75.93)性别男62 13(20.97) 0.000 0.992 45(72.58) 0.015 0.904女38 8(21.05) 28(73.68)Child-Pugh分级A 36 8(22.22) 26(72.22) 0.053 0.974 B 44 9(20.45) 0.052 0.974 32(72.72)C 20 4(20.00) 15(75.00)Edmondson分级I~II 51 11(21.57) 0.020 0.887 37(72.55) 0.011 0.917 III~IV 49 10(20.41) 36(73.47)HBV感染是60 12(20.00) 0.090 0.764 44(73.33) 0.008 0.927否40 9(22.5) 29(72.50)肿瘤直径(cm)≤5 38 8(21.05) 0.000 0.992 18(47.37) 20.429 0.000> 5 62 13(20.97) 55(88.71)淋巴结转移有34 2(5.88) 7.097 0.008 24(70.59) 0.152 0.697无66 19(28.79) 49(74.24)分化程度高分化 32 7(21.88) 0.022 0.883 23(71.88) 0.030 0.862中低分化 68 14(20.59) 50(73.53)
2.3 相关性分析
将患者Smad4和NF-κBp65蛋白表达进行相关分析,结果显示:Smad4和NF-κBp65蛋白表达呈负相关(P<0.05)(表4)。
表4 Smad4和NF-κBp65蛋白表达相关性分析

 阳性 9 12 -0.350 0.000阴性 64 15
阳性 9 12 -0.350 0.000阴性 64 15
3 讨 论
肝癌是常见的恶性肿瘤之一,其早期症状不是非常明显,不少患者被发现的时候就已经发展为晚期,而与肝癌的预后效果有关的因素较多,早期检查和治疗都是直接影响肝癌的预后效果的重要因素[7]。故而,肝癌患者一定要积极的接受治疗,要做到早发现,早预防,早治疗。但目前关于肝癌早期诊断及预后评估有效指标较为缺乏。
TGF-β作为配体形成的受体复合物,激活Smads进入核内,共同激活或抑制它们调节的靶基因的转录[8]。 Smads家族蛋白在将TGF-β信号从细胞表面受体传导至细胞核的过程中起到关键性作用,且不同的Smad介导不同的TGF-β家族成员的信号转导[9]。Smad4是TGF-β家族各类信号传导过程中共同需要的介质与肿瘤及多器官硬化具有密切联系[10]。
NF-κB主要涉及机体防御反应、组织损伤和应激、细胞分化和调亡以及肿瘤生长抑制过程的信息传递。多数细胞类型中,NF-κB在胞浆与抑制性蛋白质结合形成无活性的复合物。当肿瘤坏死因子等作用于相应受体后,可通过第二信使等激活此系统,而通过磷酸化抑制性蛋白使其构象改变而释放NF-κB,使得NF-κB得以活化;活化的NF-κB进入细胞核,接触DNA,抑制或启动相关基因转录,其中NF-κBp65蛋白是数量最高的NF-κB蛋白[11]。
本研究发现观察组Smad4蛋白阳性表达率明显低于对照组,而NF-κBp65蛋白阳性表达率明显高于对照组。上述结果提示肝癌患者存在Smad4和NF-κBp65蛋白异常表达。VEGF在肝癌中高表达,对肝癌新生血管形成及肿瘤生长和转移起重要作用。王玉恒等[12]研究提示Smad 4 具有降低肿瘤血管内皮生长因子的表达,抑制肿瘤血管形成的功能,是重要的抑癌基因并具有提高血小板反应蛋白表达的作用。肝癌患者NF-κBp65蛋白高表达可能与NF-κB的活化促进了血管基质金属蛋白酶或内皮生长因子的表达有关,而基质金属蛋白酶或内皮生长因子在肿瘤的血管发生、细胞外基质降解和癌细胞的转移过程中具有重要的调节作用。
Smad4和NF-κBp65蛋白表达与患者临床病理特征结果显示有淋巴结患者Smad4蛋白阳性表达率明显低于无淋巴结转移患者;肿瘤直径>5 cm患者NF-κBp65蛋白阳性表达率明显高于肿瘤直径≤5 cm患者。上述结果提示Smad4和NF-κBp65蛋白能够共同促进肝癌的发生发展,出现上述结果的具体机制可能是TGF-β1活化的启动子基因具有NF-κBp65蛋白结合位点,而TGF-β1表达可抑制Smad4表达,故而,Smad4能够阻碍NF-κBp65的表达诱发凋亡并调节的肿瘤的侵袭及浸润[13]。但本研究发现Smad4蛋白与肝癌患者淋巴结转移有关,而NF-Bp65与其无关,这可能与本研究样本量较少有关,具体还需要进行大样本量研究证实。
Smad 7 属于抑制型 I-Smads,抑制 TGF-β家族的信号转导,而 TGF-β在细胞的生长、分化、迁移、凋亡、免疫调节等方面发挥重要的调节作用;核因子 NF-κB 是炎症与癌的重要中介分子,许多细胞、病毒的基因组中存在κB 位点,因而众多基因转录可以被 NF-κB 调控如肝脏炎性反应相关基因、肝炎病毒相关基因、原癌基因、抑癌基因等多种基因都可以被其通过多种方式参与表达。相关性研究发现Smad4和NF-κBp65蛋白表达呈负相关(rs=-0.350,P<0.05)。上述结果提示肝癌患者的Smad4和NF-κBp65蛋白表达具有相关性。研究[14]证实胰腺癌 、胆管癌及结直肠癌多种肿瘤均存在Smad 4 基因表达显著下降,在正常肝组织,Smad 4 具有重要的调节 TGF-β信号转导通路的作用,而TGF-β对肝细胞生长具有较强的抑制作用。活化的NF-κB快速的诱导编码IkBa的基因的转录,因此产生高水平的自身抑制剂;释放后的NF-κB可以通过例如修饰自身的亚单位的方式影响自身的转录激活效能[15]。新合成的自由的IkBa进入细胞核内,然后使DNA上NF-κB解离并且将NF-κB排出细胞核,故而肿瘤多存在NF-κBp65的高表达。本研究为肝癌的相关发生机制提供了数据参考和研究对照,为今后肝癌机制的深入研究提供了基础。
综上所述,肝癌组织中Smad4表达降低,NF-κBp65蛋白表达升高,相关表达异常与淋巴结转移、肿瘤直径大小具有一定的相关性。
[1] 周争光, 汪蕊, 李玉梅, 等. mir-130a-3p及smad 4在肝细胞癌组织中的表达及临床意义[J]. 安徽医科大学学报, 2017, 52(3):383–387. doi:10.19405/j.cnki.issn1000–1492.2017.03.017.Zhou ZG, Wang R, Li YM, e al. Expressions and clinical significance of mir-130a-3p and smad 4in hepatocellular carcinoma[J]. Acta Universitatis Medicinalis Anhui, 2017,52(3):383–387. doi:10.19405/j.cnki.issn1000–1492.2017.03.017.
[2] 李斌, 孙宁, 谷松. 乌梅丸及其拆方对溃疡性结肠炎大鼠炎性因子及TLR9/MyD88/NF-κBp65信号通路的影响[J]. 中华中医药杂志, 2016, 31(5):1901–1905.Li B, Sun N, Gu S. Effects of Wumei Pill and its separated prescription on inflammatory factors and TLR9/My D88/NF-κBp65 signaling pathway in ulcerative colitis rat[J]. China Journal of Traditional Chinese Medicine and Pharmacy, 2016, 31(5):1901–1905.
[3] 王华, 倪青, 高宇哲, 等. 核因子-κBp65和细胞间黏附分子-1在浆细胞性乳腺炎中的表达意义[J]. 中华实验外科杂志, 2016,33(4):947–949. doi:10.3760/cma.j.issn.1001–9030.2016.04.022.Wang H, Ni Q, Gao YZ, et al. Expression of nuclear factor of kappa B p65 and intercellular adhesion molecule-1 and its significance in plasma cell mastitis[J]. Chinese Journal of Experimental Surgery, 2016, 33(4):947–949. doi:10.3760/cma.j.issn.1001–9030.2016.04.022.
[4] 徐志彬, 冯军波, 郑秀丽, 等. 不同食管病变组织中TGFβ1、α-SMA、smad4、VEGF蛋白表达及MVD比较[J]. 山东医药,2016, 56(6):10–12. doi:10.3969/j.issn.1002–266X.2016.06.003.Xu ZB, Feng JB, Zheng XL, et al. Comparison of expression of TGFβ1, α-SMA, smad4, VEGF and comparison of MVD in different esophageal lesions[J]. Shandong Medical Journal, 2016,56(6):10–12. doi:10.3969/j.issn.1002–266X.2016.06.003.
[5] 阮洪江, 范大鹏, 陈帅, 等. miRNA219—5P靶向调控Smad4表达影响TGF—β1诱导肌腱成纤维细胞纤维化的研究[J]. 中国修复重建外科杂志, 2016, 30(5):641–646.Ruan HJ, Fan DP, Chen S, et al. Role of Smad4 on fibrosis of tendon derived fibroblasts induced by transforming growth factor β1 by targeted regulation of miRNA219-SP[J]. Chinese Journal of Reparative and Reconstructive Surgery, 2016, 30(5):641–646.
[6] 杨琳, 卢斌, 庞晓丽, 等. 基于TGF-β1/Smad4信号探讨缺氧条件下补阳还五汤促进新生血管成熟的机制[J]. 中国实验方剂学杂志,2018, 24(3):114–119.Yang L, Lu B, Pang XL, et al. Mechanism of Buyang Huanwutang in Promoting Maturation of Neovascularization Under Hypoxia Condition Based on TGF-β_1/Smad4 Signal[J]. China Journal of Experimental Traditional Medical Formulae, 2018, 24(3):114–119.
[7] Kim DH, Chang MS, Yoon CJ, et al. Epstein-Barr virus BARF1-induced NFκB/miR-146a/SMAD4 alterations in stomach cancer cells[J]. Oncotarget, 2016, 7(50):82213–82227. doi: 10.18632/oncotarget.10511.
[8] 王亚莉, 葛建荣. 喉鳞癌组织CHD5、E-cadherin、Smad4表达变化及其意义[J]. 山东医药, 2017, 57(36):49–51. doi:10.3969/j.issn.1002–266X.2017.36.015.Wang YL, Ge JR. Expressions of CHD5, E-cadherin and Smad4 in laryngeal squamous carcinoma tissue and their significance[J].Shandong Medical Journal, 2017, 57(36):49–51. doi:10.3969/j.issn.1002–266X.2017.36.015.
[9] Velaei K, Samadi N, Soltani S, et al. NFκBP65 transcription factor modulates resistance to doxorubicin through ABC transporters in breast cancer[J]. Breast Cancer, 2017, 24(4):552–561. doi: 10.1007/s12282–016-0738–8.
[10] 张好放, 郁二蒙, 王广军, 等. 草鱼TGF-β1、Smad4基因的克隆及真核过表达和RNA干扰表达载体的构建[J]. 中国农业大学学报,2017, 22(4):120–128. doi:10.11841/j.issn.1007–4333.2017.04.13.Zhang HF, Yu EM, Wang GJ, et al. Cloning of TGF-β1,Smad4 and construction of eukaryon and RNAi expression vector from Ctenopharyngodon idellus[J]. Journal of China Agricultural University, 2017, 22(4):120–128. doi:10.11841/j.issn.1007–4333.2017.04.13.
[11] Lee H, Pyo MJ, Bae SK, et al. Nemopilema nomurai jellyfish venom exerts an anti-metastatic effect by inhibiting Smad- and NF-κB-mediated epithelial–mesenchymal transition in HepG2 cells[J].Sci Rep, 2018:2808.
[12] 王玉恒, 徐业芬, 牛家强,等. 牦牛Smad4基因mRNA组织表达谱及其miRNAs初步研究[J]. 畜牧兽医学报, 2017, 48(10):1882–1891.Wang YH, Xu YF, Niu JQ, et al. Preliminary Studies on Tissue Expression Profiles of Smad 4 mRNA and Its miRNAs in Yak[J].Acta Veterinaria et Zootechnica Sinica, 2017, 48(10):1882–1891.
[13] Moz S, Basso D, Bozzato D, et al. SMAD4 loss enables EGF,TGFβ1 and S100A8/A9 induced activation of critical pathways to invasion in human pancreatic adenocarcinoma cells[J]. Oncotarget,2016, 7(43):69927–69944. doi: 10.18632/oncotarget.12068.
[14] 杨桂美, 李芳菲, 王友亮, 等. 脑血管内皮细胞中转化生长因子β以Smad4依赖方式上调Notch4[J]. 军事医学, 2017, 41(6):415–418. doi:10.7644/j.issn.1674–9960.2017.06.002.Yang GM, Li FF, Wang YL, et al. Smad4-dependent TGF-β directly up-regulates Notch4 in cerebrovascular endothelial cells[J].Military Medical Sciences, 2017, 41(6):415–418. doi:10.7644/j.issn.1674–9960.2017.06.002.
[15] 黄盈瑞, 陈洁, 周玲玲, 等. 甲状腺乳头状癌组织中 Smad4基因表达水平及其意义研究[J]. 中国全科医学, 2016, 19(32):3961–3965.doi:10.3969/j.issn.1007–9572.2016.32.013.Huang YR, Chen J, Zhou LL, et al. Expression and Significance of Smad4 Gene in Papillary Thyroid Cancer[J]. Chinese General Practice, 2016, 19(32):3961–3965. doi:10.3969/j.issn.1007–9572.2016.32.013.