肝门部胆管癌,又称Klatskin瘤,系指发生在左、右肝管及肝总管的恶性肿瘤,占胆管癌的60%~80%[1-3]。目前,外科手术是唯一有望治愈的方法,术后5年生存率在18%~42%不等,但是仅25%的患者在初诊时有手术切除的机会[4-8]。肝门部胆管癌的姑息治疗是指当肿瘤不可能根治性切除时,设法引流胆汁、减轻黄疸、缓解症状的治疗方法,其远期疗效不及根治性切除术[2,9],但由于本病早期临床症状隐匿,大部分患者就诊时已为晚期,失去根治机会,因此姑息治疗仍是肝门部胆管癌的重要治疗方式。姑息治疗主要有两种方式,一是姑息性手术,包括胆道外引流术和胆肠内引流术,二是介入方法,如经皮肝穿刺胆道引流术(percutaneous transhepatic biliary drainage,PTBD)或胆道支架置入术,内镜下胆道支架置入术(endoscopic retrograde biliary drainage,ERBD)等[10-15]。
本文采用回顾性病例对照研究,收集近10年中南大学湘雅医院收治的218例行姑息治疗的肝门部胆管癌患者的临床及病理资料,进行门诊及电话随访、统计分析,旨在探讨肝门部胆管癌的不同姑息治疗方法的临床疗效。
1 资料与方法
1.1 一般资料
收集2005年12月—2015年11月中南大学湘雅医院收治的218例行姑息治疗的肝门部胆管癌患者的临床及病理资料,其中男114例(52.3%),女104例(47.7%);年龄31~86岁,平均57.5岁,中位年龄59岁。218例患者均经临床表现、影像学检查,或经外科手术、术后病理学检查获得诊断。
1.2 纳入标准和排除标准
纳入标准:⑴ 经姑息性手术(不包括减瘤手术)或介入治疗(PTBD或ERBD)的肝门部胆管癌患者;⑵ 未伴随其他恶性肿瘤;⑶ 治疗前后未进行其他抗肿瘤治疗;⑷ 临床资料完整。排除标准:⑴ 治疗前后行根治性手术或减瘤手术者;⑵ 治疗前后行其他抗肿瘤治疗者;⑶ 非原发性肝门部胆管癌;⑷ 临床资料不完整。
1.3 辅助检查
1.3.1 实验室检查 肝功能:谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)、碱性磷酸酶(AKP)、谷氨酰转肽酶(GGT)等。
1.3.2 肿瘤标志物 CEA、CA125、CA19-9等。
1.3.3 影像学检查 腹部超声、CT、MRI等。
1.4 治疗方法及病理学检查
姑息性手术:⑴ 胆道外引流;⑵ 胆肠内引流。介入治疗:⑴ PTBD或经皮胆道支架置入术;⑵ ERBD。姑息性手术患者术中取标本送病理学检查。
1.5 观察指标
观察患者临床表现及辅助检查结果、治疗及病理学检查结果、随访结果。患者治疗前后血清总胆红素水平、术后生存时间及1、3、5年生存率用于临床疗效分析。
1.6 随访
采用门诊及电话进行随访,以患者死亡为终点事件,了解患者生存情况。随访时时间截至2016年11月30日。
1.7 统计学处理
统计分析在SPSS 22.0统计软件中进行。计量资料用均数±标准差(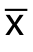 ±s)、计数资料用频数和百分比进行描述。Kaplan-Meier法估计生存率及中位生存时间、计算可信区间、绘制生存曲线;Log-rank检验进行生存率的比较。
±s)、计数资料用频数和百分比进行描述。Kaplan-Meier法估计生存率及中位生存时间、计算可信区间、绘制生存曲线;Log-rank检验进行生存率的比较。
2 结 果
2.1 临床表现及辅助检查结果
218例患者中,以黄疸起病者203例(93.1%),平均黄疸时长27 d,术前最高TBIL水平3.9~785.2 μmol/L,DBIL水平1.6~370.9 μmol/L,ALT 14.8~484.5 U/L,AST 20.4~451.4 U/L;156例检测AKP、GGT,其水平分别为93.8~1741.6 U/L、2.0~1687.2 U/L;208例检测CA19-9,增高者182例(87.5%),198例检测CEA,增高者63例(31.8%),172例检测CA242、CA125,增高者分别为110例(63.9%)、66例(38.3%)。
根据Bismuth-Corlette分型,I型8例(3.7%),II型73例(33.5%),IIIa型43例,(19.7%),IIIb型47例(21.6%),IV型47例(21.6%);根据美国癌症分期联合委员会(AJCC)第七版AJCC手册分期,I期0例,II期6例(2.8%),III期75例(34.4%),IV期104例(47.7%),未能明确分期者33例(15.1%)。
2.2 治疗
218例患者中,159例(72.9%)行姑息性手术,其中胆道外引流术134例,胆肠内引流术25例;59例(27.1%)行介入治疗,其中PTBD 27例,ERBD 32例。218例患者中有2例(0.9%)术后30 d内死亡。1例行姑息性手术后死于急性肾衰;1例行介入治疗后死于急性化脓性胆管炎、感染性休克、DIC。
2.3 术后并发症
并发症的总发生率为58.7%(128/218)。姑息性手术并发症发生率为66.0%(105/159),感染31.4%(50/159),包括胆道感染23例,肺部感染19例,腹腔感染8例,肝衰竭13.8%(22/159),胆道再次梗阻13.2%(21/159),胆道出血4.4%(7/159),胆瘘17.6%(28/159),肠瘘3.1%(5/159),切口并发症9.4%(15/159),其他3.1%(5/159);介入治疗并发症发生率为39.0%(23/59),感染39.0%(23/59),其中胆道感染20例,肺部感染3例,胆道再次梗阻22.0%(13/59),胆道出血3.4%(2/59),胆瘘8.5%(5/59)。
2.4 病理学检查
行病理学检查患者159例,腺癌156例,其中高分化4例,中分化58例,低分化19例,75例分化程度未明确,黏液腺癌3例。
2.5 随访结果
截至2016年11月30日,除外2例围术期死亡后的216例患者,有202例获得随访(姑息性手术157例,介入治疗45例),随访率93.5%,随访期间196例死亡。
2.6 临床疗效分析
2.6.1 两者治疗前后TBIL比较 157例姑息性手术患者术前及术后1周血清TBIL分别为(246.9±153.2)μmol/L和(171.8±120.9)μmol/L,下 降(80.8±93.6)μmol/L(P<0.01);45例 介入治疗患者治疗前及治疗后1周血清TBIL分别为(357.1±186.9)μmol/L和(235.85±140.17)μmol/L,下降(126.4±137.7)μmol/L(P<0.01)。
2.6.2 两者生存率比较 202例肝门部胆管癌患者1、3、5年生存率分别为29.9%、8.1%、2.3%,中位生存时间为7个月。157例姑息性手术患者1、3、5年生存率分别为33.8%、10.3%、2.9%,中位生存时间为7个月;45例介入治疗患者1、3、5年生存率分别为14.9%、0、0,中位生存时间为7个月,两者比较,差异有统计学意义(χ2=5.328,P<0.05)(表1)(图 1)。
表1 姑息性手术与介入治疗患者相关指标比较
Table 1 Comparison of the main clinical variables between patients undergoing palliative surgery and interventional treatment
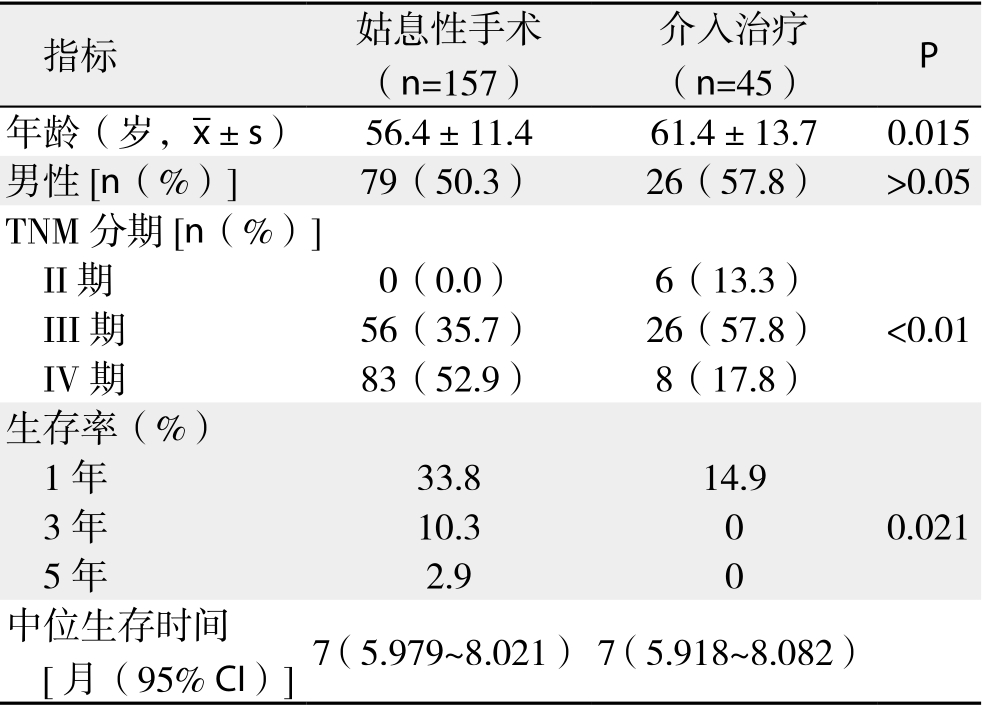
指标 姑息性手术(n=157)介入治疗(n=45) P年龄(岁,x±s) 56.4±11.4 61.4±13.7 0.015男性[n(%)] 79(50.3) 26(57.8) >0.05 TNM分期[n(%)]II期 0(0.0) 6(13.3)III期 56(35.7) 26(57.8) <0.01 IV期 83(52.9) 8(17.8)生存率(%)1年 33.8 14.9 3年 10.3 0 0.021 5年 2.9 0中位生存时间[月(95% CI)]7(5.979~8.021) 7(5.918~8.082)
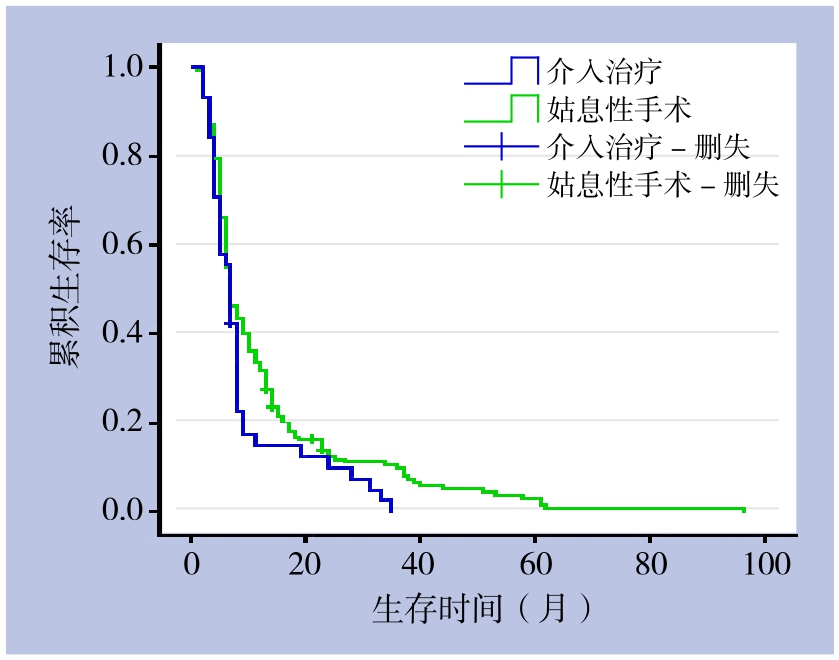
图1 不同姑息治疗方法患者的生存曲线
Figure 1 Survival curves of patients undergoing different palliative treatment
2.6.3 胆道外引流与内引流生存率比较 157例获随访的姑息性手术患者中,133例胆道外引流患者1、3、5年生存率分别为32.3%、9.0%、2.7%,中位生存时间为7个月;24例胆肠内引流患者1、3、5年生存率分别为41,7%、16.7%、4.2%,中位生存时间为8个月,两者差异无统计学意义(χ2=0.673,P>0.05)(表2)(图2)。
表2 胆道外引流和胆肠内引流患者的生存率和中位生存时间
Table 2 Survival rates and survival times of patients after external biliary drainage and internal biliary drainage
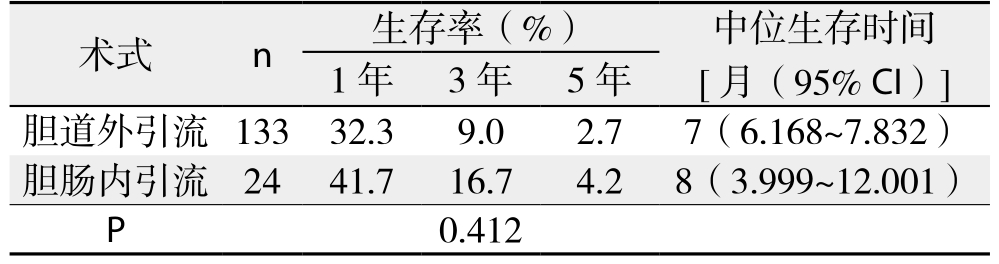
术式 n 生存率(%) 中位生存时间[月(95% CI)]1年 3年 5年胆道外引流 133 32.3 9.0 2.7 7(6.168~7.832)胆肠内引流 24 41.7 16.7 4.2 8(3.999~12.001)P 0.412
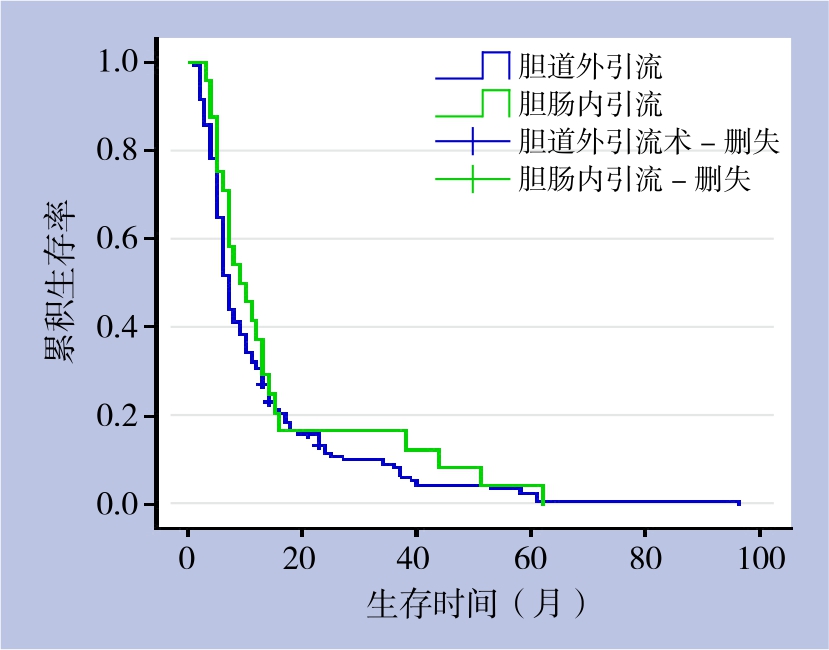
图2 不同姑息性手术方式患者的生存曲线
Figure 2 Survival curves of patients undergoing different palliative surgical procedures
2.6.4 PTBD与ERBD生存率比较 45例获随访的介入治疗患者中,19例PTBD患者1、3、5年生存率分别为15.8%、0、0,中位生存时间为7个月;24例ERBD患者1、3、5年生存率分别为13.8%、0、0,中位生存时间为7个月,两者差异无统计学意义(χ2=0.023,P>0.05)(表3)(图3)。
表3 PTBD和ERBD患者的生存率和中位生存时间
Table 3 Survival rates and survival times of patients after PTBD and ERBD
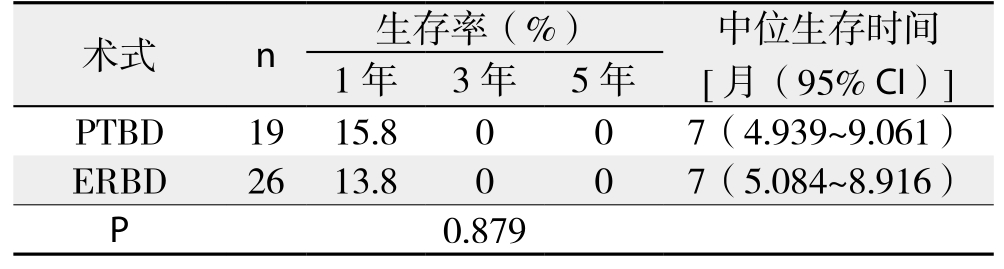
术式 n 生存率(%) 中位生存时间[月(95% CI)]1年 3年 5年PTBD 19 15.8 0 0 7(4.939~9.061)ERBD 26 13.8 0 0 7(5.084~8.916)P 0.879
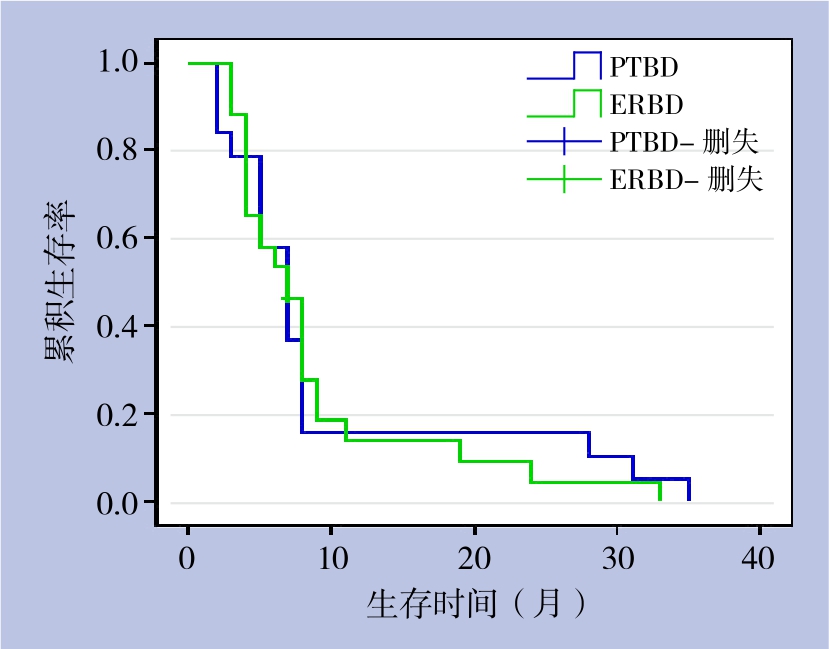
图3 不同介入治疗方式患者的生存曲线
Figure 3 Survival curves of patients undergoing different palliative interventional procedures
3 讨 论
肝门部胆管癌常被认为是一种生长较缓慢、较晚发生远处转移的恶性肿瘤,即使肿瘤局部进展为晚期,仍可能生存较长时间;本组患者5年生存率仍有2.3%,因此不能轻易放弃治疗,要想方设法为患者延长生存时间、提高生存质量。
在肝门部胆管癌的姑息治疗中,介入治疗具有微创、有效引流胆汁、可重复的特点,特别是ERBD,具有胆汁引流更符合生理特性、防止肿瘤向管腔内生长、支架通畅时间长、无需外置引流袋等特点[16],使患者的创伤更小、花费更少、生存质量更高;但存在获取病理学诊断较困难的问题。本组资料提示介入治疗后患者生存率明显低于姑息性手术,可能与介入治疗后胆道再次梗阻及胆道感染发生率较高且患者身体状况较差有关。Singhal等[10]、Li等[11]报道介入治疗与姑息性手术治疗的肝门部胆管癌患者生存率间无统计学差异,且胆肠内引流术会增加发病率和病死率。笔者认为当肿瘤不可行根治性切除时,介入治疗不失为一个很好的姑息治疗手段,尤其对于基本状况较差的高龄患者;但是姑息性手术可能使患者获得更长的生存时间,对于有条件的患者是一种较好的选择。
本组资料中ERBD治疗未发生严重并发症,引流效果理想,远期疗效与PTBD相比无明显差异。Lee等[17]认为ERBD简单、安全、有效,PTBD虽能更精确的选择引流肝叶,但并发症的发生率更高,因此建议ERBD用于Bismuth II型不可切除的肝门部胆管癌,而PTBD用于ERBD失败时或Bithmuth III/IV型不可切除的肝门部胆管癌。Hirano等[18-19]建议,肝门部胆管癌根治术前胆汁引流时,与PTBD相比,ERBD应作为首选方式,因为PTBD增加了肿瘤腹膜种植转移的风险,降低生存率,是术后发生种植转移的独立危险因素。
本组资料显示姑息性手术中,胆道外引流和胆肠内引流相比两者生存率无统计学差异,尽管胆汁内引流更符合生理特性,但是从手术复杂性来看,内引流手术比外引流更加复杂,患者受到的手术打击更大,因此,当选择姑息性手术疗法时,更倾向于胆道外引流。
目前,当术前判断肝门部胆管癌肿瘤不可根治性切除时,除上述的姑息治疗方法外,还有光动力治疗(photodynamic therapy,PDT)、射频消融术(radiofrequency ablation,RFA)及放化疗[20-24]等,这些技术为肝门部胆管癌的姑息治疗提供了新的方法,但其疗效有待进一步研究。Tada等[25]报道了不可切除的肝门胆管癌患者经新辅助化疗后,成功行了根治性切除且切缘阴性,Wagner等[26]也报道了术前PDT可以缩小肿瘤从而使手术切除成为可能,这也为进展期肝门部胆管癌患者提供了新的希望。
值得一提的是,虽然本组随访的202例肝门部胆管癌姑息治疗远期疗效总体不满意,1、3、5年生存率为29.9%、8.1%、2.3%,中位生存时间为7个月,5年生存率仍有2.3%,这也提示肿瘤本身具有异质性,且与其预后密切相关。目前关于肝门部胆管癌的研究更多的是集中在外科治疗方面的临床研究,而缺少生物学特性方面的的基础研究,然而肝门部胆管癌的生物学行为最终决定其预后,因此,对肝门部胆管癌生物学特性的进一步探索或许才能最终明显提高治疗效果。
本文为回顾性研究,具有一定的局限性,第一,治疗方法的选择标准难以控制,第二,资料的同质性不佳,如本组资料中介入治疗组患者平均年龄高于姑息性手术组,这也与高龄患者更加愿意接受创伤相对较小的介入治疗有关;姑息性治疗组中IV期患者比例较高,但似乎更加可以说明姑息性手术患者总体生存率高于介入治疗,第三,介入治疗获取病理学诊断较困难,故本研究未能控制资料的病理学类型这一混杂因素。
总之,肝门部胆管癌姑息治疗的远期疗效不佳,姑息性手术与介入治疗相比,两者均能有效引流胆汁减轻黄疸,姑息性手术患者生存率高于介入治疗,而介入治疗的方法简单、对患者创伤小,但获取病理学诊断较困难。
参考文献
[1] 高明, 项和平, 耿小平, 等. 肝门部胆管癌的诊断治疗[J]. 中国普通外科杂志, 2010, 19(8):896–898.Gao M, Xiang HP, Geng XP, et al. Diagnosis and treatment of hilar cholangiocarcinoma[J]. Chinese Journal of General Surgery, 2010,19(8):896–898.
[2] Soares KC, Kamel I, Cosgrove DP, 等. 肝门部胆管癌的诊断、治疗选择与处理策略[J]. 中国普通外科杂志, 2014, 23(8):1011–1023. doi: 10.7659/j.issn.1005–6947. 2014.08.001.Soares KC, Kamel I, Cosgrove DP, et al. Hilar cholangiocarcinoma:diagnosis, treatment options, and management[J]. Chinese Journal of General Surgery, 2014, 23(8):1011–1023. doi: 10.7659/j.issn.1005–6947.2014.08.001.
[3] 晏益核, 黄玉斌, 蔡小勇. 肝门部胆管癌的外科治疗现状[J]. 中国普通外科杂志, 2017, 26(2):246–251. doi:10.3978/j.issn.1005–6947.2017.02.019.Yan YH, Huang YB, Cai XY. Current status in surgical management of hilar cholangiocarcinoma[J]. Chinese Journal of General Surgery,2017, 26(2):246–251. doi:10.3978/j.issn.1005–6947.2017.02.019.
[4] DeOliveira ML, Cunningham SC, Cameron JL, et al.Cholangiocarcinoma: thirty-one-year experience with 564 patients at a single institution[J]. Ann Surg, 2007, 245(5):755–762.
[5] Launois B, Reding R, Lebeau G, et al. Surgery for hilar cholangiocarcinoma: French experience in a collective survey of 552 extrahepativ bile duct cancers[J]. J Hepatobiliary Pancreat Surg, 2000, 7(2):128–134.
[6] Dinant S, Gerhards MF, Rauws EA, et al. Improved outcome of resection of hilar cholangiocarcinoma(Klatskin tumor)[J]. Ann Surg Oncol, 2006, 13(6):872–880.
[7] Nagino M, Ebata T, Yokoyama Y, et al. Evolution of surgical treatment for perihilar cholangiocarcinoma: a single-center 34-year review of 574 consecutive resections[J]. Ann Surg, 2013,258(1):129–140. doi: 10.1097/SLA.0b013e3182708b57.
[8] 隋鑫磊, 汤恢焕, 肖广发, 等. 322例肝门部胆管癌的临床疗效及预后因素分析[J]. 中华消化外科杂志, 2017, 16(4):391–397. doi:10.3760/cma.j.issn.1673–9752.2017.04.015.Sui XL, Tang HH, Xiao GF, et al. Clinical efficacy and prognostic factors analysis of hilar cholangiocarcinoma in 322 patient [J].Chinese Journal of Digestive Surgery, 2017, 16(4):391–397. doi:10.3760/cma.j.issn.1673–9752.2017.04.015.
[9] 汤恢焕, 彭创, 常实, 等. 肝门部胆管癌36例诊疗体会[J]. 中华普通外科杂志, 2005, 20(10):641–643.Tang HH, Peng C, Chang S, et al. The diagnosis and treatment of hilar bile duc t carc inoma: a report of 36 cases[J]. Zhong Hua Pu Tong Wai Ke Za Zhi, 2005, 20(10):641–643.
[10] Singhal D, van Gulik TM, Gouma DJ. Palliative management of hilar cholangiocarcinoma[J]. Surg Oncol, 2005, 14(2):59–74.
[11] Li HM, Dou KF, Sun K, et al. Palliative surgery for hilar cholangiocarcinoma[J]. Hepatobiliary Pancreat Dis Int, 2003,2(1):110–113.
[12] 石力, 汤礼军, 汪涛, 等. 胆道金属支架置入治疗肝门部胆管癌的临床研究[J]. 中国普通外科杂志, 2012, 21(8):918–921.Shi L, Tang LJ, Wang T, et al. Metal biliary stent placement for hilar cholangiocarcinoma[J]. Chinese Journal of General Surgery, 2012,21(8):918–921.
[13] 蔡云峰, 苏树英, 费凛, 等. IV型肝门部胆管癌单侧塑料内支架置入治疗的前瞻性研究[J]. 中国普通外科杂志, 2010, 19(2):180–183.Cai YF, Su SY, Fei L, et al. A prospective study of unilateral placement of plastic stents for Bismuth type IV hilar cholangiocarcinoma[J]. Chinese Journal of General Surgery, 2010,19(2):180–183.
[14] 孙立新, 徐智, 周孝思. U型管支撑治疗晚期肝门部胆管癌[J]. 中国普通外科杂志, 2009, 18(8):886–888.Sun LX, Xu Z, Zhou XS. Use of U-shape stent in treatment of advanced hilar bile duct cancer[J]. Chinese Journal of General Surgery, 2009, 18(8):886–888.
[15] 周磊, 刘会春, 李宗狂, 等. 经皮胆道金属支架置入姑息性治疗肝门部胆管癌[J]. 中国微创外科杂志, 2015, 15(11):998–1000.doi:10.3969/j.issn.1009–6604.2015.11.011.Zhou L, Liu CH, Li ZK, et al. Percutaneous Biliary Metal Stent Implantation for Hilar Cholangiocarcinoma[J]. Chinese Journal of Minimally Invasive Surgery, 2015, 15(11):998–1000. doi:10.3969/j.issn.1009–6604.2015.11.011.
[16] 王庆, 秦明放, 勾承月, 等. 经内镜胆道支架置入术姑息性治疗肝门部胆管癌的临床应用[J]. 中华腔镜外科杂志:电子版, 2008,1(2):156–162.Wang Q, Qin MF, Gou CY, et al. The clinical application of endoscopic palliative biliary stent implantation for hilar cholangiocarcinoma[J]. Chinese Journal of Laparoscopic Surgery:Electronic Edition, 2008, 1(2):156–162.
[17] Lee TH, Lee SJ, Moon JH, et al. Technical tips and issues of biliary stenting, focusing on malignant hilar obstruction[J]. Minerva Gastroenterol Dietol, 2014, 60(2):135–149.
[18] Hirano S, Tanaka E, Tsuchikawa T, et al. Oncological benefit of preoperative endoscopic biliary drainage in patients with hilar cholangiocarcinoma[J]. J Hepatobiliary Pancreat Sci, 2014,21(8):533. doi: 10.1002/jhbp.76.
[19] Hwang S, Song GW, Ha TY, et al. Reappraisal of percutaneous transhepatic biliary drainage tract recurrence after resection of perihilar bile duct cancer[J]. World J Surg, 2012, 36(2):379–385.doi: 10.1007/s00268–011–1364–4.
[20] Goenka MK, Goenka U1.Palliation: Hilar cholangiocarcinoma[J].World J Hepatol, 2014, 6(8):559–569. doi: 10.4254/wjh.v6.i8.559.
[21] Wagner A, Kiesslich T, Neureiter D, et al. Photodynamic therapy for hilar bile duct cancer: clinical evidence for improved tumoricidal tissue penetration by temoporfin[J]. Photochem Photobiol Sci, 2013,12(6):1065–1073. doi: 10.1039/c3pp25425a.
[22] Figueroa-Barojas P, Bakhru MR, Habib NA, et al. S afety and efficacy of radiofrequency ablation in the management of unresectable bile duct and pancreatic cancer: a novel palliation technique[J]. J Oncol, 2013, 2013:910897. doi:10.1155/2013/910897.
[23] Larghi A, Tringali A, Lecca PG, et al. Management of hilar biliary strictures[J]. Am J Gastroenterol, 2008, 103(2):458–473.
[24] Shinchi H, Takao S, Nishida H, et al. Length and quality of survival following external beam radiotherapy combined with expandable metallic stent for unresectable hilar cholangiocarcinoma [J]. J Surg Oncol, 2000, 75(2):89–94.
[25] Tada S, Fujikawa T, Tanaka A, et al. A case of unresectable hilar cholangiocarcinoma successfully treated by gemcitabine and S-1 combination chemotherapy[J]. Gan To Kagaku Ryoho, 2012,39(8):1279–1282.
[26] Wagner A, Wiedmann M, Tannapfel A, et al. Neoadjuvant Down-Sizing of Hilar Cholangiocarcinoma with Photodynamic Therapy—Long-Term Outcome of a Phase II Pilot Study[J]. Int J Mol Sci,2015, 16(11): 26619–26628. doi:10.3390/ijms161125978.