胃肠间质瘤(gastrointestinal stromal tumor,GIST)是来源于胃肠道间叶组织的具有潜在恶性的肿瘤[1],在我国的年发病率约在10~20/100万,可发生于胃肠道、食管以及网膜系膜组织等,其中胃间质瘤的发病率最高(约占50%~60%),而在胃间质瘤中又以胃中上部最为多见[2]。尤其胃底部间质瘤因位置深在且毗邻贲门,如何兼顾手术根治性与术后患者生活质量,一直是困扰外科医生的一个难题[3]。近年来由于腹腔镜技术的快速发展以及对胃肠间质瘤生物学特性的研究进展,发现在保证切缘阴性的前提下,局部切除手术即可达到根治的效果[4]。但是对应用3D腹腔镜治疗胃底部间质瘤的报道并不多[5]。本文对2014年1月—2015年6月之间在我院手术的36例胃底间质瘤患者的临床资料进行回顾性分析,以探讨3D腹腔镜手术治疗胃底部间质瘤的临床应用价值。
1 资料与方法
1.1 研究对象
收集自2014年1月—2015年6月在我科接受手术治疗的胃底间质瘤患者36例,其中3D腹腔镜手术(3D腔镜组)与开腹手术(开放手术组)各18例,两组年龄、性别、BMI指数以及肿瘤大小均有可比性(表1)。纳入标准[6]:⑴ 所有患者术前均需经过胃镜和/或超声内镜以及腹部CT检查诊断为胃底间质瘤,肿瘤直径在2~10 cm之间,并且在术后经过病理证实;⑵ 术前未接受口服伊马替尼药物治疗;⑶ 术前ASA分级I-III级,无明显手术禁忌证。排除标准:⑴ 肿瘤<2 cm或>10 cm;⑵ 既往上腹部手术史;⑶ 术前影像学检查考虑肿瘤破裂或者侵犯周围脏器;⑷ 并存重要脏器功能不全或凝血机制障碍;⑸ 存在腹腔或远处转移可能。
表1 两组患者一般资料比较
Table 1 Comparison of the general data between the two groups of patients
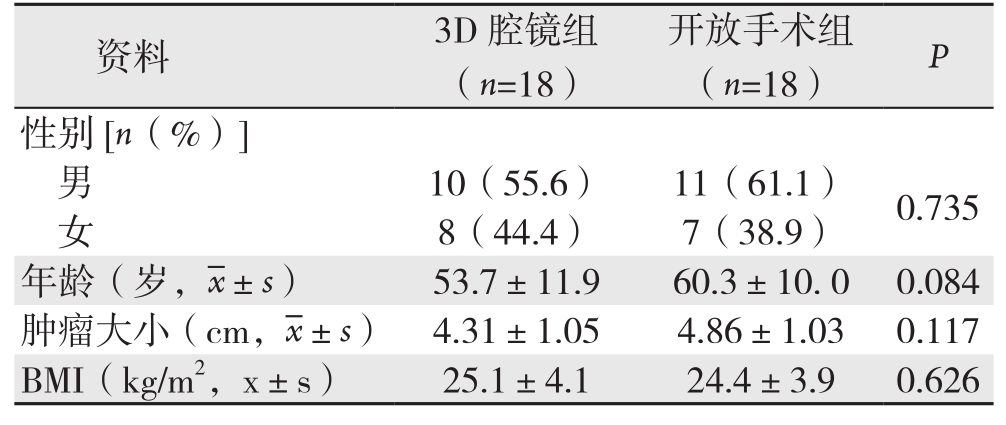
资料 3 D腔镜组(n=1 8)开放手术组(n=1 8) P性别[n(%)]男1 0(5 5.6) 1 1(6 1.1) 0.7 3 5女8(4 4.4) 7(3 8.9)年龄(岁,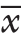 ±s) 5 3.7±1 1.9 6 0.3±1 0. 0 0.0 8 4肿瘤大小(c m,
±s) 5 3.7±1 1.9 6 0.3±1 0. 0 0.0 8 4肿瘤大小(c m,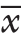 ±s) 4.3 1±1.0 5 4.8 6±1.0 3 0.1 1 7 B M I(k g/m 2,±s) 2 5.1±4.1 2 4.4±3.9 0.6 2 6
±s) 4.3 1±1.0 5 4.8 6±1.0 3 0.1 1 7 B M I(k g/m 2,±s) 2 5.1±4.1 2 4.4±3.9 0.6 2 6
1.2 手术方法
所有患者均按照快速康复外科理念进行围手术期管理,尽量不放置胃管、尿管以及腹腔引流管或者于术后早期拔除,术后充分镇痛并鼓励患者早期下床活动,减少肠外营养时间并尽早进行肠内营养治疗。手术中严格遵循肿瘤的治疗原则并且重点注意确保肿瘤完整切除,切缘阴性,并且在手术过程中避免肿瘤破碎;所有手术均为同一组有足够手术经验的医师完成,确保手术质量。手术切除标本由专门的病理科医师进行病理检查。
开放手术:全麻平卧位,上腹正中切口约8~10 cm许进腹探查,如果位于胃底前壁容易显露则用直线切割缝合器切除病灶;肿瘤位于后壁、靠近大弯侧以及贲门者多数均需延长手术切口,游离其与脾脏的关联行楔形切除或者近端胃大部切除手术。
3D腹腔镜手术:采用全身静脉麻醉,患者取平卧分腿位,主刀取左侧站位,扶镜手站于患者两腿之间。于脐下切开10 mm切口,Veress法建立气腹,压力设置为12~15 mmHg(1 mmHg=0.133 kPa),脐下置入10 mm Troca以及3D腹腔镜镜头作为观察孔,左侧腋前线肋缘下置入12 mm Troca作为主操作孔,左侧腹直肌外侧缘置入5 mm Troca,右侧肋缘下置入5 mm辅助操作孔,根据肿瘤的部位以及术中具体情况调整主操作孔位置以及是否增加辅助操作孔。对于主体为胃底前壁,呈腔外生长病灶明确的,可将病灶提起后以GIA行楔形切除;在胃底靠近大弯侧或者后壁的,切开大网膜或沿大弯侧离断胃短血管,充分显露病灶后仍然采用GIA切除;对于主体为腔内生长者,切开胃壁以后直视下切除,而后以GIA关闭胃前壁;靠近贲门且直径≥5 cm的胃底间质瘤估计楔形切除可能导致贲门狭窄的则行近端胃切除术。
1.3 观察指标
记录2组患者手术时间、术中出血量、手术切口长度;术后并发症、排气时间、住院时间等手术相关指标。手术后病理检查结果:包括肿瘤大小,切缘情况,核分裂像,免疫组织化学相关指标如CD117、CD34、DOG1、Ki67、核分裂像和Fletcher间质瘤危险度评级[7]。
1.4 术后随访
采用电话、信件及门诊复查的方式随访,对中高危患者每3个月复查1次CT或MRI,时间在18~36个月,了解有无远期并发症以及有无复发转移。对于中高危险度的患者还需要了解其是否口服伊马替尼治疗。
1.5 统计学处理
采用SPSS 22.0统计软件进行数据处理,计量资料采用均数±标准差表示,组间比较采用t检验,计数资料采用χ2检验,不符合正态分布的数据比较采用非参数秩和检验,以P<0.05为有统计学差异。
2 结 果
2.1 术后病理
检查结果显示,均未出现肿瘤破裂以及切缘阳性的情况。3D腔镜组以及开放手术组CD117+分别为17例(94.4%)、17例(94.4%);CD34+分别为16例(88.9%)、17例(94.4%);DOG1+分别为16例(88.9%)、16例(88.9%);Ki67>5%分别为2例(11.1%)、4例(22.2%),核分裂数>5个/HPF分别为6例(33.3%)、5例(27.8%);Fletcher间质瘤病理分级中高危分别为8例(44.4%)、12例(66.7%),两组各项病理指标差异无统计学意义(均P>0.05)(表2)。
表2 两组患者术后病理与免疫组化资料比较[n=18,n(%)]
Table 2 Comparison of the postoperative pathological and immunohistochemical characteristics between the two groups of patients[n=18, n(%)]
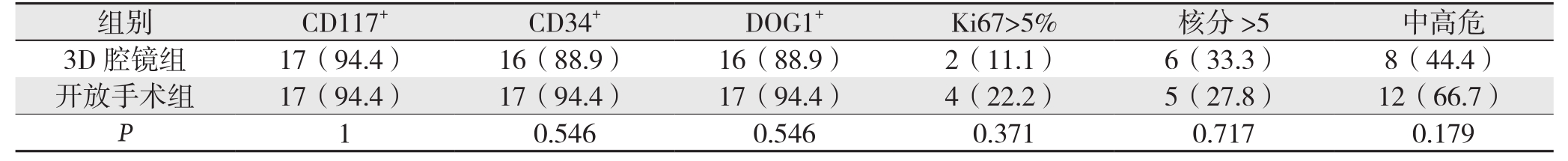
组别 C D 1 1 7+ C D 3 4+ D O G 1+ K i 6 7>5% 核分>5 中高危3 D腔镜组 1 7(9 4.4) 1 6(8 8.9) 1 6(8 8.9) 2(1 1.1) 6(3 3.3) 8(4 4.4)开放手术组 1 7(9 4.4) 1 7(9 4.4) 1 7(9 4.4) 4(2 2.2) 5(2 7.8) 1 2(6 6.7)P 1 0.5 4 6 0.5 4 6 0.3 7 1 0.7 1 7 0.1 7 9
2.2 围手术期情况
两组手术时间无统计学差异(P>0.05),但是术中出血量、术后肠道开始排气时间、住院天数以及切口长度3D腔镜组均明显优于开放手术组(均P<0.05)。两组手术患者均未出现严重术后并发症如腹腔/吻合口出血、肠梗阻、吻合口瘘等(表3)。
表3 两组患者围手术期情况比较(n=18,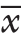 ±s)
±s)
Table 3 Comparison of the perioperative variables between the two groups of patients (n=18, 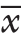 ±s)
±s)

组别 手术时间(min) 出血量(mL) 排气时间(d) 住院时间(d) 切口长度(cm)3D 腔镜组 78.3±24.2 34.7±18.6 3.1±0.94 6.8±1.0 4.7±1.1开放手术组 86.6±23.2 56.6±19.2 3.9±1.2 8.3±1.4 10.1±2.3 P 0.360 0.002 0.025 0.001 0.000
2.3 随访结果
所有患者均完成至少4次间隔3个月以上的随访,中位随访时间20(12~36)个月暂未发现有复发转移的情况,亦未出现死亡病例。除2例行近端胃大部切除手术治疗的患者诉偶有返酸不适的情况外,其余患者均未见明显手术相关的远期并发症如粘连性肠梗阻等。在病理危险度分级在中高危以上的患者中,腹腔镜手术组6例(6/8)以及开放手术组8例(8/12)遵医嘱服用伊马替尼至少1年,其余6例患者均因为费用方面问题未能服药。
3 讨 论
尽管近年来随着对胃肠间质瘤生物学行为的认识逐渐深入,已经建立了包括消化内镜医师,外科医师、病理科、肿瘤科和影像科的多学科治疗模式,但是外科手术仍然还是治疗间质瘤最主要和最有效的手段[8]。当前间质瘤外科手术的基本共识是扩大切除手术并不能改善间质瘤的预后,需要重视的是手术中避免挤压肿瘤,尽量保证肿瘤假包膜的完整以及确保切缘阴性,一般不需要进行淋巴结清扫和联合脏器切除[9]。因此对胃间质瘤而言,除非是过于靠近贲门或者幽门,大部分的肿瘤都可以通过楔形切除手术的方式获得安全的切缘[10]。本研究也证实了这一点,两组均只有各1例患者因为肿瘤过于靠近贲门采用了近端胃大部切除术,其余均采用楔形切除手术完成。
胃间质瘤约占所有胃肠间质瘤的60%,而其中又以中上部最为多见,尤其是胃底部的肿瘤,因为解剖位置的关系,周围与肝脏、脾脏毗邻,又靠近膈肌与贲门,尤其如果肿瘤位于胃后壁,开放手术没有足够大的切口很难充分显露肿瘤,真正的切除肿瘤时间并不需要太长的时间。因此腹腔镜技术应用于胃间质瘤的切除手术是具有天然优势[11]。也有学者[12]认为腹腔镜手术因为没有触感,可能在寻找肿瘤的过程当中容易导致破损,或者切除的边界不够容易导致残留。现在随着技术的发展也有研究认为腹腔镜切除胃间质瘤安全得到了越来越多的认可[13]。
当前的3D腹腔镜技术能够得到高清三维立体视野,术中可以更清楚的辨识病变部位与周围组织结构,弥补传统腹腔镜平面图像无法感知组织间纵深关系的不足,有利于术中的精细操作,从而减少副损伤和并发症的发生率[14]。在从2D转向3D操作的初期可能会对手术视野深度产生误判,手术者会有头晕目眩的情况,但是随着手术例数的积累术者习惯3D视野以后将会获得更好的手术效果[15]。并且间质瘤多数靠腔外生长,2 cm以上的肿瘤在腔镜下寻找病灶很容易,如果靠腔内生长的可以行术中胃镜定位帮助显露,内镜下切割闭合器头部可以旋转弯曲可以更好的进行楔形切除[16]。在我们实际的操作中,极少因为技术问题不能腔镜下完成手术而需要中转。但我们仍然需要注意把握好手术指征,对于<2 cm的间质瘤,优先采用内镜下切除[17];有文献[18]报道,即便是直径12 cm的胃间质瘤,腹腔镜手术切除也是可行的,安全有效的。尽管从笔者的经验看,相比于肿瘤的大小而言肿瘤距离贲门的距离更为重要,但是对于直径10 cm以上的肿瘤,有条件的话尽可能先口服药物治疗使肿瘤缩小以后再手术切除[19]。从手术时间看,3D腹腔镜手术组与开放手术组并无统计学差异,这与笔者在术中操作较为谨慎,严格避免直接钳夹拨弄肿瘤有关。但是在术中出血量、术后排气时间、住院时间和切口长度这些指标上腹腔镜手术组有明显优势。
从病理检查的结果来看,3D腹腔镜手术组与开放手术一样同样可以获得安全的切缘,注意用取物袋取出标本,避免切口过小强行取出肿瘤时导致肿瘤的破裂,至少在短期内肿瘤的复发转移方面没有明显的差别,中远期疗效则需要进一步的观察。另外需要注意的一个问题在于,在3D腔镜组和开放手术组患者中高危的比例分别为44.4%、66.7%,但其中术后口服伊马替尼治疗的比例分别为75%、66.7%,仍然有相当比例的患者因为各种各样的原因不能完成术后药物治疗,可能会对远期疗效产生比较大的影响[20]。
目前的3D腹腔镜可以提供立体纵深感,及镜头可以多方位旋转,可以比传统2D腹腔镜更好的辨别解剖层次和毗邻脏器的关系,对于在开放手术情况下比较困难的贲门胃底部肿瘤刚好是其优势所在。因此笔者认为如果能够广泛的推广和应用3D腹腔镜技术,可以给这部分患者带来不劣于开放手术的根治性效果,并且能够获得更小的手术切口,更低的手术并发症发生率的近期疗效。
参考文献
[1] Jo VY, Fletcher CD. WHO classification of soft tissue tumours:an update based on the 2013 (4th) edition[J]. Pathology, 2014,46(2):95–104. doi: 10.1097/PAT.0000000000000050.
[2] 中华医学会外科学分会胃肠外科学组. 胃肠间质瘤规范化外科治疗专家共识[J]. 中国实用外科杂志, 2015, 35(6):593–598.doi:10.7504/CJPS.ISSN1005–2208.2015.06.04 Gastrointestinal Surgery Group, Surgery Society, Chinese Medical Association. Expert consensus on standardized surgical treatment of gastrointestinal stromal tumors[J]. Chinese Journal of Practical Surgery, 2015, 35(6):593–598. doi:10.7504/CJPS.ISSN1005–2208.2015.06.04.
[3] Kim JW, Yoon H, Kong SH, et a1. Analysis of esophageal re fl ux after proximal gastrectomy measured by wireless ambulatory 24-hr esophageal pH monitoring and TC-99m diisopropyliminodiacetic acid (DISIDA) scan[J]. J Surg Oncol, 2010, 101(7):626–633. doi:10.1002/jso.21560.
[4] Casali PG, Jost L, Reichardt P, et al. Gastrointestinal stromal tumours: ESMO clinical recommendations for diagnosis, treatment and follow-up[J]. Ann Oncol, 2009, 20(Suppl 4):64–67. doi:10.1093/annonc/mdp131.
[5] 洪希周, 马君俊, 臧潞, 等. 3D腹腔镜手术系统在胃肠肿瘤根治术中的应用[J]. 国际外科学杂志, 2015, 42(7):445–449. doi:10.3760/cma.j.issn.1673–4203.2015.07.005.Hong XZ, Ma JJ, Zang L, et al. Retrospective analysis: the application of 3D laparoscopy in gastric surgery and colorectal surgery[J]. International Journal of Surgery, 2015, 42(7):445–449.doi:10.3760/cma.j.issn.1673–4203.2015.07.005.
[6] 李子禹, 邢兆东, 王警, 等. 腹腔镜在胃间质瘤手术治疗中应用价值研究[J]. 中国实用外科杂志, 2015, 35(4):426–429. doi:10.7504/CJPS.ISSN1005–2208.2015.04.22.Li ZY, Xing ZD, Wang J, et al. Laparoscopic resection for gastric stromal tumor[J]. Chinese Journal of Practical Surgery, 2015,35(4):426–429. doi:10.7504/CJPS.ISSN1005–2208.2015.04.22.
[7] Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach[J]. Hum Pathol, 2002, 33(5):459–465.
[8] CSCO胃肠间质瘤专家委员会. 中国胃肠间质瘤诊断治疗共识(2013年版)[J]. 临床肿瘤学杂志, 2013, 18(11):1025–1032.CSCO Gastrointestinal Stromal Tumor Expert Committee. Chinese Consensus on diagnosis and treatment of gastrointestinal stromal tumors (2013 edition)[J]. Chinese Clinical Oncology, 2013,18(11):1025–1032.
[9] Corless CL, Fletcher JA, Heinrich MC. Biology of gastrointestinal stromal tumors[J]. J Clin Oncol, 2004, 22(18):3813–3825.
[10] De Vogelaere K, Van Loo I, Peters O, et al. Laparoscopic resection of gastric gastrointestinal stromal tumors (GIST) is safe and effective, irrespective of tumor size[J]. Surg Endosc, 2012,26(8):2339–2345. doi: 10.1007/s00464–012–2186–7.
[11] Kitano S, Shiraishi N. Minimally invasive surgery for gastric tumors[J]. Surg Clin North Am, 2005, 85(1):151–164.
[12] Lukaszczyk JJ, Preletz RJ Jr. Laparoscopic resection of benign stromal tumor of the stomach[J]. J Laparoendosc Surg, 1992,2(6):331–334.
[13] Kasetsermwiriya W, Nagai E, Nakata K, et al. Laparoscopic surgery for gastric gastrointestinal stromal tumor is feasible irrespective of tumor size[J]. J Laparoendosc Adv Surg Tech A, 2014, 24(3):123–129. doi: 10.1089/lap.2013.0433.
[14] 王锡山. 3D腹腔镜技术在微创外科中的现状与思考[J].中华结直肠疾病电子杂志, 2014, 3(3):177–179. doi:10.3877/cma.j.issn.2095–3224.2014.03.03.Wang XS. The current application of 3D laparoscopy technics in minimally invasive surgery[J]. Chinese Journal of Colorectal Diseases, 2014, 3(3):177–179. doi:10.3877/cma.j.issn.2095–3224.2014.03.03.
[15] Usta TA, Karacan T, Naki MM, et al. Comparison of 3-dimensional versus 2-dimensional laparoscopic vision system in total laparoscopic hysterectomy: a retrospective study[J]. Arch Gynecol Obstet, 2014, 290(4):705–709. doi: 10.1007/s00404–014–3253–1.
[16] De Vogelaere K, Hoorens A, Haentjens P, et al. Laparoscopic versus open resection of gastrointestinal stromal tumors of the stomach[J].Surg Endosc, 2013, 27(5):1546–1554. doi: 10.1007/s00464–012–2622–8.
[17] Sawaki A, Mizuno N, Takagi T, et al. Gastric submucosal tumors:Lessons learned from 10-year follow-up[J]. J Clin Oncol, 2009,27(15 Suppl):e15631. doi: 10.1200/jco.2009.27.15s.e15631.
[18] Masoni L, Gentili I, Maglio R, et al. Laparoscopic resection of large gastric GISTs: feasibility and long-term results[J]. Surg Endosc,2014, 28(10):2905–2910. doi: 10.1007/s00464–014–3552–4.
[19] Hohenberger P, Oladeji O, Licht T, et al. Neoadjuvant imatinib and organ preservation in locally advanced gastrointestinal stromal tumors (GIST)[J]. J Clin Oncol, 2009, 27(15 Suppl):10550. doi:10.1200/jco.2009.27.15_suppl.10550.
[20] DeMatteo RP, Ballman KV, Antonescu CR, et al. Adjuvant imatinib mesylate after resection of localised,primary gastrointestinal stromal tumour: a randomised,double-blind,placebo-controlled trial[J]. Lancet, 2009, 373(9669):1097–1104. doi: 10.1016/S0140–6736(09)60500–6.
